الفيروس المضخم للخلايا هو جنس من عائلة فيروس الهربس. بشكل أكثر تحديدًا ، فيروس الهربس البشري من النوع 5. لذلك فإن آلية العدوى والأعراض وطرق الكشف تشبه عدوى فيروس الهربس. تتناول هذه المقالة مدى خطورة الفيروس على الجسد الأنثوي وأعراضه وتشخيصه وعلاجه.
معلومات عامة عن المرض
يتكاثر الفيروس المضخم للخلايا داخل الخلية ، مما يكتسب أبعادًا عملاقة وينهار. من المثير للدهشة أن حوالي 40٪ من السكان الذين بلغوا سن الثلاثين لديهم أجسام مضادة للفيروس المضخم للخلايا في دمائهم. هذا يشير إلى أن الفيروس يعيش في الجسم لفترة طويلة. ومع ذلك ، فإن مظاهره لا تحدث للجميع. يسبب الفيروس انتكاسة في الجسم مع ضعف الحماية. فترة الحضانة(الوقت من لحظة الإصابة إلى ظهور العلامات الأولى للمرض) يتراوح من 20 إلى 60 يومًا. في هذه المرحلة ، يتراكم الفيروس ويتكاثر في الخلية. ثم تأتي الفترة الحادة. لسوء الحظ ، في الطب لا يوجد طرق فعالةعلاج الفيروسات.
أنسجة مشيمة امرأة مصابة بـ CMV
كيف يدخل الفيروس الجسم؟
لا يمكن أن تنتقل عدوى الفيروس المضخم للخلايا إلا من البشر. يتم استبعاد العدوى من الحيوانات. هناك طرق الإرسال التالية:
- محمول بالهواء - تصاب امرأة من حامل للفيروس عن طريق العطس والسعال والتقبيل.
- الاتصال بالمنزل - عند استخدام الأواني العامة ومواد النظافة.
- جنسي.
- من الأم إلى الطفل. يحدث هذا من خلال المشيمة في الرحم أو من خلال حليب الثدي عندما يولد الطفل بالفعل.
الأهم من ذلك كله ، أن الفيروس المضخم للخلايا يحب ملء الغدد اللعابية. يوجد الفيروس في جميع وسائط الجسم البيولوجية - اللعاب والبول والإفرازات المهبلية والسائل المنوي والقيء.
علاج فعال للسرطان في إسرائيل بدون وسطاء.
يُعتقد أن الفيروس لطيف للغاية ويموت بسرعة تحت تأثير درجات الحرارة المرتفعة أو المنخفضة والكحول والمطهرات الأخرى. ومع ذلك ، فإن النساء عرضة للإصابة بالفيروس المضخم للخلايا ، ومع ذلك ، من أجل الإصابة ، من الضروري الاتصال الوثيق والمطول مع شخص مصاب.
ما هي أعراض الفيروس المضخم للخلايا؟
لا تسبب عدوى الفيروس المضخم للخلايا أعراض محددةأي علامات مميزة فقط لهذا المرض. تتنكر العدوى في صورة أمراض أخرى. في كثير من الأحيان الجسد الأنثوييمكن أن تظهر على أنها سارس. ستشعر المرأة بالضعف وسيلان الأنف والتهاب الحلق والقشعريرة وانخفاض درجة الحرارة. قد تكون هناك أعراض تسمم عام بالجسم: غثيان ، ضعف ، تعرق ، إعياء.

ومع ذلك ، هناك عدد من العلامات التحذيرية التي لا ينبغي تجاهلها:
- لا تنخفض درجة الحرارة لأكثر من أسبوع ؛
- تضخم الغدد الليمفاوية المؤلمة.
- يظهر طفح جلدي على الجسم ، كما هو الحال مع الحصبة الألمانية - نقاط حمراء صغيرة.
مرة واحدة في الجسم ، يبقى الفيروس المضخم للخلايا فيه إلى الأبد. تأخذ العملية شكلاً مزمنًا. بمعنى آخر ، لا شيء يزعج المرأة ، ولا توجد أعراض إكلينيكية. يشير هذا إلى أن الفترة الحادة قد مرت ، وأصبح الفيروس أقل نشاطًا ويجلس بهدوء داخل الخلية ، وهو في حالة نائمة (كامنة).
متى يكون الفيروس خطيرا؟
من أجل صحة المرأة ، يعد الفيروس المضخم للخلايا ذا أهمية خاصة ، لأنه يسبب تغيرات في أداء الأعضاء التناسلية ، ويؤدي إلى تآكل عنق الرحم والتهاب المبيضين.
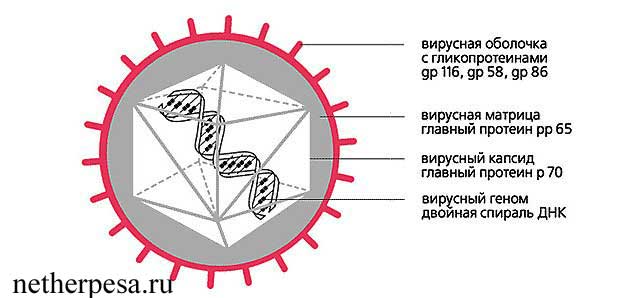
مخطط فيروس الفيروس المضخم للخلايا
الفيروس لا يظهر بأي شكل من الأشكال ، في حين أن جسم المرأة يعمل بسلاسة. في أدنى فشل للجهاز المناعي ، يصبح الفيروس نشطًا وتظهر الشكاوى الأولى. عند الوصول إلى موعد مع الطبيب ، ستدفع الصورة الموصوفة أخصائيًا للتفكير في عدد كريات الدم البيضاء. يتجلى هذا المرض أيضًا من خلال زيادة الغدد الليمفاوية ، حرارة عالية، طفح جلدي ، تلف الكبد والطحال. ومع ذلك ، فهو ناتج عن فيروس مختلف تمامًا (إبشتاين بار). هناك حالات تعاني فيها حصانة المرأة:
- الحمل (الجسم يعمل لشخصين) ؛
- علم الأورام.
- عدوى فيروس نقص المناعة البشرية.
يعتبر الحمل وقتًا رائعًا ، ولكنه أيضًا مدعاة للقلق. الحقيقة هي أن رد الفعل الوقائي للجسم ينخفض بشكل حاد ويزداد خطر الإصابة بالعدوى المختلفة.
هناك رأي بين الخبراء أنه إذا أصيبت المرأة بفيروس قبل الحمل ، فإن الأخير لا يسبب أبدًا أمراضًا في نمو الجنين. لكن الوضع يتغير إذا دخل الفيروس الجسم بعد الحمل. يتسبب الفيروس المضخم للخلايا في حدوث تشوهات جنينية ، والعمى ، وتلف الجهاز العصبي المركزي (يؤدي إلى الخرف) ، كما يتسبب في الإجهاض والإجهاض التلقائي. تكون العدوى خطيرة بشكل خاص في الأشهر الثلاثة الأولى ، عندما يتم وضع أعضاء وأنظمة الجنين.
تتساءل الكثير من النساء عما إذا كان الأمر يستحق إرضاع أطفالهن. حليب الثدي؟ يعتقد بعض أطباء الأمراض المعدية أنه إذا لم يكن الفيروس المضخم للخلايا نشطًا ، فلن يكون هناك أي ضرر من حليب الثدي. ومع ذلك ، يفضل معظمهم التغذية الاصطناعية.
أما بالنسبة للنساء المصابات بالسرطان ، فهن بوجه عام ضعيفات أمام العوامل البيئية. ويرجع ذلك إلى تناول العلاج الكيميائي والعلاج بمضادات التجلط - الأدوية التي تمنع النمو خلايا سرطان. لذلك ، بالنسبة للأشخاص الذين لديهم تاريخ مرهق ، فإن الاجتماع قصير الأمد مع حامل للفيروس يهدد الإصابة بنسبة 100٪.

تستحق النساء المصابات بفيروس نقص المناعة البشرية اهتمامًا خاصًا. الحقيقة هي أن فيروس نقص المناعة البشرية والإيدز ليسا تشخيصًا ، بل حالة من الجسم يكون فيها الجهاز المناعي مكتئبًا بشدة وغير قادر على مقاومة أي فيروسات. في هذه الحالة ، يتكاثر الفيروس المضخم للخلايا بسرعة كبيرة ، ويملأ جميع الأعضاء تقريبًا ويسبب عمليات لا رجعة فيها. هذا بسبب نقص خلايا CD 4 (الخلايا المناعية).
مع الإيدز ، تكون العملية معممة - مع مجرى الدم ، ينتشر الفيروس إلى جميع الأعضاء. غالبًا ما تصاب النساء المصابات بفيروس نقص المناعة البشرية بالعمى التدريجي ، وحتى الخرف. CMV (الفيروس المضخم للخلايا) لا يجنب الدماغ ويؤدي إلى التهاب أغشيته وأنسجته.
يؤثر CMVI (عدوى الفيروس المضخم للخلايا) و الجهاز الهضمي. هي السبب التهاب القولون المزمن، تقرحات ، تآكل الغشاء المخاطي للمعدة والأمعاء. يسبب الفيروس المضخم للخلايا الإمساك والإسهال عند النساء. مثل هذه الاضطرابات في عمل الأمعاء لا يمكن علاجها.
التحليل في حالة الاشتباه بنمو جنيني غير طبيعي
ما الاختبارات التي يجب إجراؤها للكشف عن الفيروس؟
بسبب ال الشخص السليمالفيروس لا يزعج بأي شكل من الأشكال ، ثم يتم اكتشافه بالصدفة البحتة ، على سبيل المثال ، عندما تسجل امرأة في عيادة ما قبل الولادة. وتعيش العديد من الإناث مع الفيروس طوال حياتهن ولا يعرفن شيئًا. ومع ذلك ، إذا ذهبت إلى الطبيب مع بعض الشكاوى ، فسوف يقدم لك طرق الفحص التالية:
- السيرولوجي - دراسة مصل الدم ، وتحديد الأجسام المضادة لمستضد (فيروس) فيه. هذه هي الطريقة الأبسط والأكثر تكلفة وموثوقية لتحديد CMV. يجب أن يأتي المريض إلى المختبر على معدة فارغة ويتبرع بـ 5 مل. الدم من الوريد.
- فيروسية - لهذه الطريقة ، يتم استخدام المواد البيولوجية وتنميتها في زراعة الخلايا. تستغرق هذه الطريقة وقتًا طويلاً جدًا.
- خلوي - يتم فحص شظايا الأنسجة تحت المجهر. نادرا ما تستخدم هذه الطريقة.
الدراسة الأكثر إفادة للدم من الوريد. في الفترة الحادة ، سيكتشف مساعد المختبر الغلوبولين المناعي للمجموعة M في المادة ، إذا أصبحت العملية مزمنة - الغلوبولين المناعي G. إذا تم العثور على كل من الغلوبولين المناعي في الدم ، فهذا يشير إلى تفاقم التركيز المزمن.
ما الأدوية التي يمكن أن تعالج المرض؟

- نظرًا لأن تضخم الخلايا ناتج عن فيروس ، فإنه يتم علاجه بالأدوية المضادة للفيروسات. في الأساس ، هذه مشتقات من الإنترفيرون - Viferon ، Protyflazid. يتم تناول هذه الأدوية بدقة وفقًا للمخطط ، مع مراعاة وزن المريض.
- كما ذكر أعلاه ، لا يتطلب الفيروس المضخم للخلايا العلاج. يكفي للحفاظ على جهاز المناعة في حالة جيدة. لهذا ، فمن المستحسن أن تأخذ كل ستة أشهر مجمعات فيتامين- ريفيت ، فيتروم ، سوبرادين.
- يمكنك شرب الأدوية المضادة للفيروسات بشكل دوري لإبقاء الفيروس في "وضع النوم". يجب توضيح جميع الأسئلة المتعلقة بالعلاج فقط من قبل الطبيب.
- إذا كانت المرأة حامل ، فإن العلاج من قبل أخصائي الأمراض المعدية تحت إشراف طبيب التوليد وأمراض النساء ضروري.
- في الفترة الحادة ، بالإضافة إلى تناول الأدوية المضادة للفيروسات ، يتم إزالة الأعراض المختلفة.
- عند درجة حرارة ، توصف خافضات الحرارة - ايبوبروفين ، باراسيتامول ، أنجين ، أسبرين.
- مع سيلان الأنف واحتقان الأنف - مضيق للأوعية (naphthyzine ، noxprey ، evkazolin).
- للقضاء على التعرق والتهاب الحلق ، يصف الأطباء أقراص مص.
- إذا كان هناك طفح جلدي على الجسم ، يتم تشحيمه مرتين في اليوم بمحلول الفوكارسين ، ويمسح الوجه بالكحول. يحلل الأطباء الشكاوى والأعراض ، ثم يضعون خطة علاجية شاملة.
طرق الوقاية الفعالة. أنها لا وجود لها؟
في في الآونة الأخيرةيعمل العلماء ليس فقط على العلاج ، ولكن أيضًا على الوقاية من الفيروس المضخم للخلايا. تم تطوير لقاح مؤخرًا ، ولكن ، للأسف ، تبين أنه غير فعال. أصيب الأشخاص الملقحون بالفيروس وكذلك غير الملقحين. لمنع الإصابة بالفيروس المضخم للخلايا ، من المناسب اتباع أسلوب حياة صحي ، وتجنب الازدحام ، وغسل يديك بعد وسائل النقل العام ، والابتعاد عن العطس والسعال.
عدوى الفيروس المضخم للخلايا ليست حكما بالإعدام. لا يتطلب علاجًا فوريًا. الشيء الرئيسي هو الحفاظ على مناعتك في المستوى المناسب. إذا كان عليك التعامل مع الفيروس المضخم للخلايا ، فقم بمشاركة الطرق التي عولجت بها ، وما إذا كانت فعالة.
يهدف علاج الفيروس المضخم للخلايا في جميع الحالات إلى تقليل تأثير العدوى على الجسم نفسه (لا يمكن أبدًا إزالة الفيروس تمامًا من الجسم). في الغالبية العظمى من الحالات ، بعد الإصابة ، يتحمل الجسم عادة التفشي الأولي للعدوى ، ولا ينبغي هنا علاج الفيروس المضخم للخلايا. وهذا ينطبق على كل من البالغين والأطفال من سن الرضاعة. في الحالة الأخيرة ، يمكن حتى لعدوى الفيروس المضخم للخلايا الخلقية أن تسبب مجموعة معينة من الأعراض ، والتي تختفي دون أثر بعد ظهور قصير.
في أغلب الأحيان ، لا يسبب الفيروس المضخم للخلايا بعد هزيمة الجسم أي أعراض على الإطلاق ، فالشخص المصاب يعاني من عدوى دون أي عواقب ويكتسب مناعة قوية مدى الحياة. ومع ذلك ، فإن الفيروس نفسه يبقى في الجسم في شكل كامن ، وفي حالة الضعف الشديد للمناعة ، يمكن أن يسبب انتكاسات مصحوبة بمضاعفات مختلفة.
يجب أن يتم علاج الفيروس المضخم للخلايا فقط في الحالات التي قد تشكل فيها العدوى خطراً على الجسم. يمكن للطبيب فقط تحديد مثل هذه الحالات ، ومهمة المريض هي فقط تشخيص أعراض محددة بنفسه والاتصال على الفور بأخصائي إذا كانت هناك علامات على تضخم الخلايا المعمم عدوى فيروسية.
متى يكون علاج الفيروس المضخم للخلايا ضروريًا حقًا؟
تشمل المواقف المحددة التي يصف فيها الطبيب علاجًا للفيروس المضخم للخلايا عدة حالات:
- شكل معمم من عدوى الفيروس المضخم للخلايايرافقه عمليات التهابية واسعة النطاق اعضاء داخلية. غالبًا ما يحدث هذا على خلفية تطور عدوى بكتيرية أو فيروسية أخرى في الجسم ، مما يضعف جهاز المناعة. يمكن أن يحدث هذا الشكل في المرضى من أي عمر.
- مسار معقد من عدوى الفيروس المضخم للخلاياسمة من سمات الأطفال حديثي الولادة. في هذه الحالة ، تكون الأعراض والمضاعفات التي تظهر على شكل التهاب رئوي أو التهاب الدماغ أو التهاب المشيمية والشبكية خطيرة ، على الرغم من عدم ملاحظة تفاقم معمم للعدوى. العلاج هنا مطلوب لتجنب حدوث انتهاكات في نمو الطفل والموت.
- التحضير للعلاجات التي تتطلب قمع المناعة. تشمل طرق العلاج هذه زرع الأعضاء والأنسجة ومكافحة السرطان. في هذه الحالات ، حتى مع عدم وجود أعراض سابقة لعدوى الفيروس المضخم للخلايا ، يمكن أن تظهر بشكل خطير فور تثبيط المناعة.
- وجود عيوب مناعية خلقية أو مكتسبة لدى المريض في أي عمر.
- ظهور العدوى الأولية بالفيروس المضخم للخلايا عند النساء الحوامل، خاصة على التواريخ المبكرةالحمل ، عندما يكون للفيروس القدرة على إحداث أضرار جسيمة للجنين وحتى التسبب في الإجهاض والإجهاض.
يتميز الشكل المعمم وتفاقم أعراض عدوى الفيروس المضخم للخلايا بحقيقة أن العديد من المرضى (وأحيانًا الأطباء الذين يراقبونهم) يمكن أن يخطئوا في أن هذه العدوى تشبه أعراض سارس ذات طبيعة أنفلونزا أو أمراض أخرى ، مما يؤدي إلى معاملة غير لائقةوخطر الإصابة بمضاعفات.
من خلال التشخيص الصحيح للفيروس المضخم للخلايا ، يمكن وصف المريض للعلاج المناسب بمساعدة الأدوية الخاصة.
أدوية لعلاج الفيروس المضخم للخلايا
الجميع الأدويةيمكن تقسيم علاج عدوى الفيروس المضخم للخلايا إلى خمس مجموعات كبيرة:
- الأدوية المضادة للفيروسات التي تمنع تكاثر الفيروس في الجسم - Ganciclovir ، Foscarnet ، Cidofovir ، Panavir.
- الجلوبولينات المناعية القادرة على ربط وتدمير الجزيئات الفيروسية - Cytotect ، NeoCytotect ، Megalotect.
- أجهزة المناعة التي تحفز استعادة وتقوية المناعة: Cycloferon ، Leukinferon ، Viferon ، Neovir ، Roferon A.
- عقاقير العلاج Posyndromic المستخدمة لاستعادة الأعضاء والأنسجة المتضررة من العدوى.
- وسائل علاج الأعراض التي توفر الراحة أو التخفيف من مظاهر الأعراض نفسها - المسكنات ، قطرات مضيق للأوعيةفي الأنف ، الأدوية المضادة للالتهابات ، قطرات العين ، الأدوية التقليدية المختلفة.
من الضروري التفكير بالتفصيل في الأنواع الثلاثة الأولى من الأدوية ، والتي تعتبر وسائل علاج محدد خصيصًا لعدوى الفيروس المضخم للخلايا.
Ganciclovir في علاج الفيروس المضخم للخلايا: قواعد الإدارة ، موانع الاستعمال ، التوصيات
Ganciclovir هو واحد من أكثر الأدوية فعالية ، ولكن في نفس الوقت يصعب استخدامه. يتم وصفه لمسار عدوى الفيروس المضخم للخلايا المعقدة بسبب أمراض الأعضاء الشديدة ، والتهاب واسع النطاق ، وعدوى الفيروس المضخم للخلايا عند الأطفال حديثي الولادة ، وكذلك للوقاية من عدوى الفيروس المضخم للخلايا في المرضى المصابين بفيروس نقص المناعة البشرية والمرضى الذين يخضعون للعلاج المضاد للأورام أو زرع الأعضاء.
يتم إنتاج Ganciclovir على شكل مسحوق خاص. يجب تناوله مع الطعام أو عن طريق الوريد ، مذابًا في 100 مل من محلول ملحي أو 2 ٪ محلول جلوكوز.
يتم حساب الجرعة بمعدل 5 ملغ من الدواء لكل 1 كجم من وزن الجسم. يتم إعطاء الدواء عن طريق الوريد لمدة ساعة مرتين في اليوم لمدة 2-3 أسابيع. في المستقبل ، يتم إجراء علاج الصيانة بمعدل 5 مجم لكل 1 كجم من وزن الجسم يوميًا أو 6 مجم لكل 1 كجم من وزن الجسم 5 مرات في الأسبوع.
يمكن وصف Ganciclovir لالتهاب الشبكية الحاد المضخم للخلايا. في هذه الحالة ، يتم استخدام جرعة 3 جرام يوميًا ، مقسمة إلى 3-6 جرعات خلال اليوم.
Ganciclovir سام للغاية وله الكثير آثار جانبية: فقر الدم ، قلة الصفيحات ، قلة العدلات ، التهاب الكبد ، الاضطرابات العصبية ، فقدان الشهية ، بيلة دموية ، طفح جلدي، ألم في صدرواشياء أخرى عديدة. لا ينصح بتناوله أثناء الحمل أو الرضاعة.
يمكن للطبيب فقط أن يصف Ganciclovir ويضبط الجرعة المطلوبة من استخدامه.
Foscarnet: ميزات استخدامه
من حيث الفعالية ضد الفيروس المضخم للخلايا والسمية للجسم ، لا تختلف Foscarnet عمليًا عن Ganciclovir.
يتم استخدامه عن طريق الوريد بمعدل 180 مجم لكل كيلوجرام من وزن الجسم يوميًا ، مقسمة إلى ثلاث حقن خلال اليوم - للبالغين ، و 90-120 مجم لكل كيلوجرام من وزن الجسم يوميًا - للأطفال.
Foscarnet قادرة على توفير تأثيرات سامةفي جميع أجهزة الأعضاء تقريبًا ، مما يتسبب في حدوث اضطرابات في عملها وآثار جانبية خطيرة. لذلك ، يتم وصفه فقط في الحالات القصوى تدفق كثيفعدوى الفيروس المضخم للخلايا. يحظر استخدام Foscarnet من قبل النساء الحوامل والمرضعات.
يعمل Panavir أكثر ليونة من Ganciclovir و Foscarnet ، ومع ذلك ، فإن فعاليته في قمع نشاط الفيروس المضخم للخلايا أقل بكثير. متوفر كحل للحقن وجل للاستخدام الخارجي ويستخدم في مكافحة التهابات فيروس الهربسأنواع مختلفة.

لعلاج الفيروس المضخم للخلايا ، يتم استخدام حل للإعطاء عن طريق الوريد. الجرعة العلاجية هي 1 أمبولة لكل 200 ميكروغرام ، وتدار محتوياتها ثلاث مرات في الأسبوع الأول من العلاج كل 48 ساعة ومرتين في الأسبوع الثاني بفاصل ثلاثة أيام.
تشير الدراسات إلى انخفاض سمية Panavir ، ولكن لا ينصح باستخدامه من قبل النساء الحوامل والأطفال دون سن 12 عامًا.
Cytotect وخصائص استقباله
Cytotect هو العلاج الأمثل لعدوى الفيروس المضخم للخلايا للعديد من المرضى.فهو يجمع بين الفعالية العالية والغياب شبه الكامل للسمية وموانع الاستعمال ، والتي بسببها موصوفة في المقام الأول لحديثي الولادة المصابين بعدوى الفيروس المضخم للخلايا حديثي الولادة.
يتم إعطاؤه للمرضى بمعدل 2 مل لكل كيلوغرام من وزن الجسم يوميًا بفاصل يوم ، 3-5 مرات ، أو بجرعة مزدوجة - بفاصل 3 أيام. بعد 5 جرعات ، حتى تتحسن الحالة ، يتم إعطاء 2 مل لكل كيلوغرام من وزن الجسم يوميًا 1-3 مرات.
ظهرت مؤخرا في السوق نسخة جديدةالمناعي - NeoCytotec:
زاد NeoCytotec من فعاليته ضد الفيروس ويتطلب إعطاء 1 مل لكل كيلوغرام من وزن الجسم يوميًا على فترات يومية. عادة ما يتم وصف 3-5 حقن.
المعدلات المناعية
تستخدم مستحضرات هذه المجموعة لزيادة دفاعات الجسم وتحفيز مكافحته المستقلة للفيروس.
في علاج عدوى الفيروس المضخم للخلايا ، يتم استخدام Roferon A و Leukinferon و Viferon بكميات تبلغ 500000 وحدة دولية على فترات في اليوم لمدة شهر.
يُنصح أيضًا باستخدام محرضات الإنترفيرون - Cycloferon و Neovir بالكميات الموصى بها في التعليمات الخاصة بهذه الأدوية لمدة أسبوعين.
من المهم أن تتذكر أن العديد من الخبراء لا يتعرفون على مُعدِّلات المناعة وسيلة فعالةلعلاج عدوى الفيروس المضخم للخلايا لدى الأطفال الذين تقل أعمارهم عن سنة واحدة ، لأنهم لم يطوروا مناعة كاملة في هذا الوقت.
أجهزة المناعة: صديق أم عدو؟
القواعد العامة لعلاج الفيروس المضخم للخلايا
في الحالات التي يكون فيها علاج عدوى الفيروس المضخم للخلايا ضروريًا ، عادة ما يتم اللجوء إلى العلاج في المستشفى والمرضى الخارجيين. بالنسبة للمواليد الجدد والمرضى الذين يعانون من نقص المناعة والذين يخضعون لعلاجات محددة ، فهذا أمر لا بد منه.
أثناء العلاج ، يكون المريض مصدرًا نشطًا للغاية للعدوى للآخرين ، لذلك يحتاج إلى الحد من الاتصال بالآخرين قدر الإمكان وضمان السلام والظروف المناخية المثلى.
من الضروري هنا أيضًا الالتزام بالوصفات الصحية والمرضى الخارجيين - التغذية الخاصة ، والكثير من السوائل وطرق أخرى للتخفيف من الأعراض المرتبطة بعدوى الفيروس المضخم للخلايا.
في ظل هذه الظروف وجميع الوصفات الطبية للطبيب ، يمكنك الاعتماد على سريع و التخلص الفعالمن عدوى الفيروس المضخم للخلايا وعدم وجود مضاعفات في المستقبل.
عدوى الفيروس المضخم للخلاياهو علم أمراض معدي ينتمي إلى فئة العدوى الانتهازية البشرية ، والتي تتميز بدورة كامنة وخفيفة نسبيًا وهي خطيرة فقط في حالات نقص المناعة التي يعاني منها الشخص ، وكذلك أثناء الحمل عند النساء ، بسبب التأثير الضار على الرحم تطور الجنين.
يعود أول ذكر لخلايا عملاقة محددة تحتوي على شوائب غريبة في النواة إلى عام 1882 في التجارب العلمية لعالم الأمراض الألماني X. Ribbert. صاغ العالمان E. Goodpasture و F. Talbot اسم "الخلايا المضخمة للخلايا" في عام 1921. تم إجراء عزل وتحديد العامل المسبب لعدوى الفيروس المضخم للخلايا في عام 1956 من قبل العالم L.
إذا أخذنا في الاعتبار مستوى القابلية الطبيعية للأشخاص للإصابة بالفيروس المضخم للخلايا ، فيجب ملاحظة ذلك هذا المرضيتميز بالتوزيع في كل مكان في شكل سريري كامن وغالبًا ما يرتبط ظهور الأعراض الأولية للمرض بنوبة تفاقم نقص المناعة.
بسبب التنوع الطرق الممكنةالعدوى بالعامل المسبب لعدوى الفيروس المضخم للخلايا ، وكذلك تعدد الأشكال للصورة السريرية للمرض ، يعلق أخصائيو الأمراض المعدية أهمية وبائية واجتماعية كبيرة على هذه الأمراض المعدية.
غالبًا ما تتسبب عدوى الفيروس المضخم للخلايا الخلقية في تطور العديد من أمراض الفترة المحيطة بالولادة ، والخداج والإملاص ، فضلاً عن تكوين التشوهات الخلقية.
يتم الجمع بين عدوى الفيروس المضخم للخلايا المزمنة في السكان البالغين في معظم الحالات مع حالات نقص المناعة المختلفة. تتقدم عدوى الفيروس المضخم للخلايا لدى النساء بشكل كبير في وتيرة التطور بسبب التلوث البيئي المستمر ، واستخدام الأدوية المثبطة للخلايا والمناعة. بالإضافة إلى ذلك ، تحدث أعراض عدوى الفيروس المضخم للخلايا لدى النساء في معظم الحالات أثناء تفاقم الإصابة بفيروس نقص المناعة البشرية. ليس في جميع الحالات التي تحدث فيها عدوى الفيروس المضخم للخلايا أثناء الحمل المزمن ، ويلاحظ تلف الجنين. يزداد خطر الإصابة بالعدوى داخل الرحم للجنين بشكل ملحوظ مع العدوى الأولية بالممرض أثناء الحمل. يمكن أن تتطور عدوى الفيروس المضخم للخلايا في أي وقت من السنة ، بغض النظر عن الظروف الجوية.
الأسباب والعامل المسبب لعدوى الفيروس المضخم للخلايا
إن دور العامل المسبب للفيروس المحدد لعدوى الفيروس المضخم للخلايا هو فيريون جينوم DNA ينتمي إلى جنس الفيروس المضخم للخلايا والفصيلة الفرعية Betaherpesvirinae ، التي تنتمي إلى مجموعة متنوعة من عائلة Herpesviridae. لا يُعرف حاليًا سوى ثلاث سلالات من الفيروس. لا يترافق تكاثر الفيروس مع موت الخلايا ، مما يؤدي إلى التسبب في المرض التدريجي ببطء. يتميز العامل الممرض للفيروس المضخم للخلايا بمقاومة متزايدة للعوامل البيئية ويحدث تعطيله فقط عند تسخينه وتعريضه لدرجات حرارة عالية للغاية. كما أن الوجود المطول للمواد المصابة في بيئة حمضية يضر بالفيروس الممرض.
يعمل الشخص الذي يعاني من هذه الأمراض المعدية كمستودع ومصدر لانتشار عدوى الفيروس المضخم للخلايا. المواد البيولوجية للبحث عن وجود عدوى الفيروس المضخم للخلايا في الجسم هي: اللعاب ، محتويات البلعوم الأنفي ، الدموع ، البول ، البراز ، السائل المنوي ، الإفرازات المهبلية.
يمكن أن تنتقل عدوى الفيروس المضخم للخلايا بطرق مختلفة ، من بينها الأكثر شيوعًا هي العدوى المحمولة جواً وعبر المشيمة والاتصال.
غالبًا ما تتطور عدوى الفيروس المضخم للخلايا عند النساء عند الإصابة بالعدوى الجنسية. تتأثر فئة البالغين الذين يعانون من هذه العدوى أثناء زراعة الأعضاء الداخلية ، وكذلك نقل الدم للدم المصاب.
تتطور عدوى الفيروس المضخم للخلايا الخلقية عند الأطفال حديثي الولادة مع انتقال الفيروس المضخم للخلايا عبر المشيمة ، على الرغم من أن العدوى أثناء الولادة للرضيع أكثر شيوعًا. اتضح في حالة وجود عدوى بالفيروس المضخم للخلايا أثناء الحمل تأثير خبيثعلى نمو الجنين.
اعتمادًا على آلية انتقال الفيروس المضخم للخلايا ، يمكن أن تعمل الهياكل المختلفة كبوابات دخول لدخول عامل معدي. جسم الانسان(الغشاء المخاطي للجهاز التنفسي ، الجهاز الهضميأو الأعضاء التناسلية الخارجية). مع تغلغل الجزيئات الفيروسية في الدم ، لوحظ تطور فيريمات قصيرة المدى ، متبوعًا بإدخال الفيروسات في خلايا الكريات البيض وحيدات الخلايا ، والتي هي توطين للتكاثر.
تزداد الخلايا المصابة بالفيروس المضخم للخلايا تدريجياً إلى حجم كبير وتكتسب سمات مورفولوجية غريبة وشوائب نووية. حول الخلايا المضخمة للخلايا ، يتشكل تسلل الخلايا اللمفاوية الخلالي تدريجياً ويتسلل عقيدية ، وتتطور التكلسات والتليف في هياكل مختلفة من جسم الإنسان ، فضلاً عن تكوينات غدية محددة في أنسجة المخ.
في بعض المرضى المصابين بعدوى الفيروس المضخم للخلايا ، هناك استمرار كامن طويل الأمد للفيروس في هياكل الجهاز اللمفاوي. ومع ذلك ، فإن عدوى الفيروس المضخم للخلايا المزمنة تثير القمع المناعة الخلويةبسبب العمل الخلوي المباشر. تتفاقم حالات نقص المناعة المختلفة مثل فترة الحمل ، واستخدام الأدوية السامة للخلايا ومثبطات المناعة ، وعدوى فيروس نقص المناعة البشرية ، المصحوبة في المقام الأول بانتهاك المناعة الخلوية ، نتيجة التعرض المباشر للفيروس المضخم للخلايا ، والذي يترافق سريريًا مع تعميم الدم. عملية مرضية.
يعتبر متخصصو الأمراض المعدية عدوى الفيروس المضخم للخلايا النشطة كمؤشر على ضعف المناعة الخلوية ؛ وعادة ما يتم تضمين هذا المرض في فئة الأمراض المرتبطة بالإيدز.
أعراض وعلامات الإصابة بالفيروس المضخم للخلايا
يتميز علم الأمراض المعدية مثل عدوى الفيروس المضخم للخلايا بمجموعة متنوعة من الخيارات لمسار الصورة السريرية ، ومع ذلك ، في معظم المرضى ، يتم ملاحظة تطور الأشكال تحت الإكلينيكية للمرض ونقل الفيروس الكامن.
تتجلى أعراض عدوى الفيروس المضخم للخلايا عند النساء في حالة تطور نقص المناعة. اعتمادًا على ظروف تكوين الصورة السريرية ، تنقسم عدوى الفيروس المضخم للخلايا إلى أشكال خلقية ومكتسبة ، والتي يمكن أن تستمر وفقًا لنوع الدورة التدريبية الحادة المعممة أو عدد كريات الدم البيضاء.
لا تظهر أعراض عدوى الفيروس المضخم للخلايا الخلقية مباشرة بعد ولادة الطفل ، ولكنها تظهر على المدى الطويل على أنها صمم ، والتهاب المشيمية والشبكية مع ضمور في العصب البصري ، وتدهور معرفي ، وضعف في الكلام.
في الحالات التي تتطور فيها عدوى الفيروس المضخم للخلايا في الأشهر الثلاثة الأولى من الحمل ، في 50٪ من الحالات ، تحدث وفاة الجنين داخل الرحم ، بالإضافة إلى تكوين تشوهات جسيمة في الهياكل المختلفة (عدم تنسج رئوي ، رتق المريء ، نقص تنسج الكلى ، حالات شاذة في تطور الجهاز الصمامي للقلب).
مع إصابة الجنين داخل الرحم في أواخر الحمل ، يكون خطر الإصابة بعيوب جسيمة في حده الأدنى ، وتبرز الحالات المرضية مثل معقد الأعراض النزفية الحادة واليرقان المتني واليرقان الانسدادي). بالإضافة إلى ذلك ، تظهر على بعض الأطفال علامات التهاب رئوي خلالي والتهاب الأمعاء والقولون والبنكرياس المتعدد الكيسات والتهاب الكلية والتهاب السحايا والدماغ في فترة حديثي الولادة ، كدليل على وجود عدوى بالفيروس المضخم للخلايا.
تتميز عدوى الفيروس المضخم للخلايا الخلقية في الفترة الحادة بتعميم العملية المرضية والدورة الشديدة والمضاعفات البكتيرية.
لوحظت الأشكال المكتسبة من عدوى الفيروس المضخم للخلايا في طب الأطفال في الفئة العمرية الأكبر سنًا ، وكذلك بين مجموعة البالغين ، وتتميز بمسار سري تحت سريري كامن. في الحالة التي يتطور فيها شكل حاد من عدوى الفيروس المضخم للخلايا لدى المريض ، فإن ظهور المظاهر السريرية يشبه متلازمة شبيهة بالإنفلونزا.
في المرضى البالغين الذين يعانون من أي شكل من أشكال حالات نقص المناعة متفاوتة الشدة ، لوحظ تطور عدوى الفيروس المضخم للخلايا المعممة ، ونتيجة لذلك يتم ملاحظة تلف جميع أعضاء الجسم البشري ، والذي يتجلى سريريًا من خلال أعراض مشابهة لتلك الموجودة في تعفن الدم. عادة ما يكون لهذا النوع من عدوى الفيروس المضخم للخلايا نتائج غير مواتية.
المرضى الذين يعانون من الإيدز والمصابين بعدوى الفيروس المضخم للخلايا غالبًا ما يصابون بالتهاب الدماغ المزمن والاعتلال الدماغي تحت الحاد ، ويتجلى ذلك من خلال زيادة اللامبالاة وحتى تطور الخرف. يعاني بعض المرضى المصابين بالفيروس المضخم للخلايا على خلفية الإيدز من التهاب الشبكية والعمى التدريجي بسبب تطور مناطق النخر على الشبكية.
تعد عدوى الفيروس المضخم للخلايا أحد العوامل المسببة للأمراض الهامة التي تعقد عمليات زرع الأعضاء. في الحالة التي يصيب فيها المريض بعد زرع أي أعضاء داخلية ، يكون المرض مصحوبًا بالحمى ونقص الكريات البيض والتهاب الكبد والالتهاب الرئوي والتهاب القولون والتهاب الشبكية ، والتي يحدث تطورها في أواخر فترة ما بعد الجراحة.
تكون أعراض عدوى الفيروس المضخم للخلايا أكثر حدة أثناء الإصابة الأولية ، وليس عند تنشيط المسار الكامن لعدوى الفيروس المضخم للخلايا.
يتطور الالتهاب الرئوي الفيروسي ، باعتباره متغيرًا سريريًا لمسار عدوى الفيروس المضخم للخلايا ، في 20 ٪ من الحالات ، ولكن هذا المرض له معدل وفيات مرتفع للغاية ، يتجاوز 88 ٪.
يمكن أن تحدث عدوى الفيروس المضخم للخلايا أثناء الحمل في متغيرات سريرية مختلفة مع وجود آفة سائدة في الحمة الكبدية والرئوية ، وكذلك الدماغ. الشكاوى الشائعة للمرضى في هذه الحالة هي الشعور بالضيق التدريجي ، وزيادة التعب ، وظهور إفرازات مخاطية من الأنف ، والتهاب ووجع في إسقاط الغدد اللعابية تحت الفك السفلي. نتيجة للتغييرات المذكورة أعلاه ، لوحظ تكوين ارتباط حميم للنسيج المشيمي للمشيمة مع تطور انفصال سابق لأوانه عن المشيمة الموجودة بشكل طبيعي ، فقدان كميات هائلة من الدمأثناء الولادة.
عدوى الفيروس المضخم للخلايا عند الأطفال
وفقًا لإحصاءات منظمة الصحة العالمية ، بناءً على نتائج العديد من الدراسات العلمية ، فإن ما يقرب من 90 ٪ من البالغين والأطفال مصابون بمسببات الفيروس المضخم للخلايا.
تتشابه الآليات الممرضة لتطور عدوى الفيروس المضخم للخلايا عند الأطفال مع تلك التي تحدث عند الإصابة بفيروس الهربس البسيط ، أي بالفعل أثناء الاتصال الأولي. جسم الطفلمع الفيروس ، يتم إدخاله في الخلايا ، حيث يحتفظ بعلامات النشاط الحيوي طوال الحياة. تكمن مسألة خطر الإصابة بالفيروس المضخم للخلايا فيما يتعلق بجسم الطفل فقط في تنشيط الفيروس في المواقف العصيبة المختلفة.
تحدث الإصابة بالفيروس المضخم للخلايا لجسم الطفل ، كقاعدة عامة ، عن طريق الاتصال وفي مثل هذه الحالة الصورة السريريةالمرض كامن. في حالة التكوين الخلقي لعدوى الفيروس المضخم للخلايا عند الأطفال ، فإن مجموعة كاملة من الظروف المرضيةتشكل تهديدًا لكل من صحة وحياة الطفل.
هناك مجموعة خطر تتكون من الأطفال حديثي الولادة ، وكذلك الأطفال الذين يعانون من أي شكل من أشكال أمراض نقص المناعة. أي أن نشاط الأعراض السريرية لعدوى الفيروس المضخم للخلايا لدى الأطفال يعتمد بشكل مباشر على حالة جهاز المناعة لدى الطفل.
يصاحب العدوى الخلقية بالفيروس المضخم للخلايا في ما يقرب من 70 ٪ من الحالات تكوين تشوهات جسيمة في تطوير الهياكل المركزية. الجهاز العصبيوالمفاصل وكذلك عيون وأعضاء السمع. تكمن نشأة تطور عدوى الفيروس المضخم للخلايا الخلقية في حقيقة أن حقيقة العدوى تحدث إما أثناء التطور النشط داخل الرحم ، أو في وقت الولادة.
من المستحيل التحقق من عدوى الفيروس المضخم للخلايا في طب الأطفال دون استخدام تدابير التشخيص المخبرية ، ومن بينها طريقة المقايسة المناعية للإنزيم هي الأكثر شيوعًا. المهمة الأساسية للطبيب المعالج ليست فقط إثبات حقيقة وجود عدوى بالفيروس المضخم للخلايا في جسم الطفل ، ولكن أيضًا لتحديد طبيعة العدوى. تتشابه عدوى الفيروس المضخم للخلايا الخلقي عند الأطفال سريريًا مع العدوى الناتجة عن انتفاخ الفيروس إلى الأنسجة اللمفاوية ، ويتجلى ذلك من خلال زيادة في مجموعات مختلفة الغدد الليمفاويةوالتغيرات الالتهابية في اللوزتين وتضخم الكبد والطحال واضطرابات الجهاز التنفسي. عواقب هذا النوع من المرض هي تكوين الحول عند الطفل ، واليرقان الانحلالي ، وضعف ردود الفعل الخلقية.
مع لفترات طويلة بالطبع السريريةتسبب عدوى الفيروس المضخم للخلايا عند الطفل فقدان الشهية وفقدان الوزن واضطراب النوم الليلي والقلق الشديد.
أثناء الفحص الأولي للطفل وتقييم المظاهر السريرية للمرض ، يجب على الطبيب أن يأخذ في الاعتبار أن أعراض عدوى الفيروس المضخم للخلايا الخلقية تظهر ، كقاعدة عامة ، في الفترة البعيدة بعد الإصابة.
يتم استخدام العلاج الدوائي لعدوى الفيروس المضخم للخلايا عند الأطفال من قبل متخصصي الأمراض المعدية فقط للتكوين الخلقي للمرض ، والذي يحدث بشكل حاد. إن استخدام أي نوع من العلاج لا يعني الموت الكلي للفيروسات المضخمة للخلايا ، بل الهدف التدابير الطبيةهو الحد الأقصى لتثبيط نشاط الفيروس والوقاية من التطور المحتمل للمضاعفات. الدواء المفضل في العلاج من الإدمانعدوى الفيروس المضخم للخلايا عند الأطفال هي Ganciclovir.
عدوى الفيروس المضخم للخلايا عند البالغين
في الأفراد الذين لا يعانون من أي شكل من أشكال ضعف المناعة ، يمكن أن يكون لعدوى الفيروس المضخم للخلايا مختلف الاعراض المتلازمة. تشمل الأعضاء المعرضة للتلف بسبب الفيروس المضخم للخلايا الكبد والدماغ والرئتين. لا يحدث ضرر للكلى والغدد الكظرية والغدد اللعابية والبنكرياس والمريء مع عدوى الفيروس المضخم للخلايا عند البالغين ، كقاعدة عامة.
العدوى الأولية لشخص بالغ مصاب بالفيروس المضخم للخلايا لا تترافق مع تطور الأعراض السريرية المرضية ، ولكنها تستمر بشكل كامن. تتطور صورة سريرية حية للمرض في الفترة البعيدة بعد الإصابة (بعد شهرين) ويصاحبها ظهور أعراض مميزة من أصل فيروسي أو بكتيري. تستمر عدوى الفيروس المضخم للخلايا عند البالغين مع أعراض وهنية طويلة الأمد في فترة النقاهة ، ويتجلى ذلك من خلال "".
في فئة البالغين من المرضى ، غالبًا ما يتطور الالتهاب الرئوي الفيروسي المضخم للخلايا ، والذي يتميز بمسار شديد التعقيد. الأشخاص الذين خضعوا لزرع الأعضاء الداخلية أو نخاع العظام في أي فترة من حياتهم يتميزون بانتهاك جهاز المناعة ، وبالتالي ، فإنهم معرضون بشكل كبير لخطر الإصابة بالفيروس المضخم للخلايا.
عدوى الفيروس المضخم للخلايا ، والتي تحدث في شكل التهاب رئوي ، تتجلى في ضيق التنفس والحمى ، وبالتالي ، كان لا بد من التمييز بينها وبين الالتهاب الرئوي من مسببات الالتهاب الرئوي. يصعب علاج هذا النوع من عدوى الفيروس المضخم للخلايا بالأدوية. العلاج المضاد للفيروساتوبذلك يصل معدل الوفيات إلى 70٪.
كما أن المرضى الذين يعانون من فيروس نقص المناعة البشرية معرضون للخطر أيضًا بين السكان البالغين ، حيث تظهر العلامات السريرية لتلف أعضاء الجهاز الهضمي في المقدمة. من الصعب للغاية تقييم مدة مسار عدوى الفيروس المضخم للخلايا ، لأنه في معظم الحالات يستمر علم الأمراض بشكل كامن. التكوين الخلقي هذا المرضلم ير في السكان البالغين. دورة حادةتتطور عدوى الفيروس المضخم للخلايا عند البالغين أثناء الاتصال الجنسي ، وكذلك بعد نقل الدم.
يعد الشكل المعمم لعدوى الفيروس المضخم للخلايا نادرًا للغاية عند البالغين ويتجلى في تكوين العديد من الارتشاح الالتهابي في الطحال والبنكرياس ، وكذلك في الكلى. يرتبط تطور هذه العمليات الالتهابية بوظيفة غير كافية لجهاز المناعة ، وكقاعدة عامة ، تتعقد بسبب العدوى البكتيرية.
في الحالة التي تتطور فيها عدوى الفيروس المضخم للخلايا في شخص سليم لا يعاني من خلل في أداء جهاز المناعة ، تصل مدة الإصابة بدون أعراض إلى 60 يومًا. ظهور الأعراض السريرية لأول مرة بشكل تدريجي ويتجلى في ظهور تفاعل حمى فرعي ، وألم عضلي ، وزيادة ضعف المريض. تدريجيا ، يعاني المريض من زيادة في حجم مجموعات مختلفة من الغدد الليمفاوية. في معظم الحالات ، يكون هذا النوع من عدوى الفيروس المضخم للخلايا عرضة للانحدار الذاتي.
وبالتالي ، فإن الأعراض السريرية لعدوى الفيروس المضخم للخلايا ليست مرضية وتشبه أعراض عدوى الجهاز التنفسي الفيروسية الحادة ، ولكن الاختلاف الرئيسي هو مدة الفترة السريرية النشطة ، والتي يمكن أن تصل في فئة البالغين من المرضى إلى عدة أشهر. المرضى الذين يعانون من هذه الأمراض المعدية منذ اليوم الأول للإصابة وحتى في أواخر فترة النقاهة يعتبرون معديين للآخرين.
في نصف الذكور من السكان البالغين ، يمكن أن تكون عدوى الفيروس المضخم للخلايا بمثابة محفز الأمراض الالتهابيةكلا الجهازين البولي والتناسلي ، الأول علامة سريريةوهو ألم عند التبول.
تشخيص عدوى الفيروس المضخم للخلايا
إجراء تشخيصات عالية الجودة في حالة عدم وجود إمكانية للتطبيق اختبارات المعمل، مع عدوى الفيروس المضخم للخلايا غير ممكن. ترجع هذه الحقيقة إلى حقيقة أن الإصابة بالفيروس المضخم للخلايا لا تترافق مع ظهور أعراض سريرية محددة.
في تشخيص عدوى الفيروس المضخم للخلايا ، يتم استخدام مجموعة كاملة من التدابير التشخيصية المخبرية ، والمواد البيولوجية الخاصة بها هي اللعاب وغسيل القصبات والبول والسائل النخاعي والدم وعينات الخزعة وحليب الثدي. عند تسليم المواد البيولوجية لاختبار عدوى الفيروس المضخم للخلايا ، فإن الامتثال لنظام درجة الحرارة وفترات التخزين ، التي يجب ألا تتجاوز 4 ساعات ، له أهمية كبيرة.
في فحص المرضى الذين يشتبه في إصابتهم بعدوى الفيروس المضخم للخلايا ، يفضل المتخصصون نوع البحث الفيروسي والخلوي والمصلي. يصل مؤشر الموثوقية للطريقة الخلوية إلى 70٪ ، لكن التحليل الفيروسي أكثر شيوعًا حاليًا. العامل المحدد لاستخدام التحليل الفيروسي في تشخيص عدوى الفيروس المضخم للخلايا هو مدى تعقيده وطول فترة تنفيذه.
ليس في جميع الحالات ، يمكن لمساعدي المختبر التعرف على الفيروس نفسه ، ومع ذلك ، فإن اكتشاف مستضداته عن طريق طريقة تفاعل التألق المناعي ، والمقايسة المناعية الإنزيمية ، وتهجين الحمض النووي ، وتشخيصات تفاعل البوليميراز المتسلسل يمكن الاعتماد عليها. نتيجة إيجابيةفي تحديد حقيقة إصابة الجسم بالفيروس المضخم للخلايا.
الأكثر إفادة فيما يتعلق بتشخيص عدوى الفيروس المضخم للخلايا ، وكذلك معظم أنواع الأمراض المعدية ، هي طريقة تشخيص PCR ، والتي تتيح لك التحقق من التشخيص في أي مرحلة من مراحل تطور علم الأمراض.
تعتمد تقنية مقايسة الممتز المناعي المرتبط بالإنزيم على اكتشاف ELISA لمستضد الفيروس المضخم للخلايا ، وكذلك تحديد العيار أجسام مضادة محددة. ومع ذلك ، فإن هذه التقنية ليست مفيدة في دراسة الأشخاص الذين يعانون من اضطرابات في جهاز المناعة.
يتم حاليًا تشخيص عدوى الفيروس المضخم للخلايا داخل الرحم بنجاح منذ الأيام الأولى من الحياة ، وهذا يعني اكتشاف طفل حديث الولادة مصاب بفئة Ig M خلال الأسبوعين الأولين بعد الولادة.
عند تشخيص عدوى الفيروس المضخم للخلايا أثناء الحمل ، يجب أن يؤخذ في الاعتبار تقارب الأجسام المضادة المكتشفة وشغفها. وهكذا ، يشير التقارب إلى درجة تشابه الجسم المضاد الذي تم تطويره مع مستضد الفيروس الممرض. تشير الطرافة إلى درجة ارتباط الجسم المضاد وجزيئات المستضد. تقييم شدة هاتين المعلمتين مهم لتحديد مدة الإصابة ، وكذلك تقييم طبيعة الدورة. عملية معدية.
تتضمن المرحلة الأولية من عدوى الفيروس المضخم للخلايا الكشف عن الأجسام المضادة الخاصة بالفيروس من فئة IgM ، أثناء إنتاج الأجسام المضادة IgGيحدث في المستقبل البعيد. يمكن للأجسام المضادة عالية التقارب أن تنتشر في الجسم طوال الحياة ، وتتمثل وظيفتها في توفير مناعة خاصة بنوع معين.
في الحالة التي لا يتجاوز فيها مؤشر شغف المريض 30٪ ، يتوصل اختصاصيو الأمراض المعدية إلى نتيجة حول العدوى الأولية. يشير مؤشر 30-40٪ لصالح عدوى حديثة ، بينما مؤشر الشغف الذي يزيد عن 40٪ دليل على وجود إصابة سابقة في فترة طويلة الأمد.
علاج عدوى الفيروس المضخم للخلايا
علاج عدوى الفيروس المضخم للخلايا صعب للغاية ، بسبب حقيقة ذلك مستحضرات طبيةالملف الشخصي المضاد للفيروسات مثل Acyclovir و Vidarabine و Virazole في معظم الحالات لا يفعل ذلك التأثير الدوائي، وفي بعض المرضى ، لوحظ تطور ردود فعل متناقضة. مجال استخدام Ganciclovir بجرعة محسوبة 5 ميكرون لكل كيلوغرام من وزن المريض عن طريق الوريد هو الكشف عن علامات التهاب الشبكية الفيروسي المضخم للخلايا لدى المريض ، بينما في الأشكال السريرية الأخرى لهذا المرض ، لا يشار إلى استخدامه. يؤدي الاستخدام طويل الأمد لـ Ganciclovir في معظم المواقف إلى تطوير طيف كامل ردود الفعل السلبية(ضرر سام للكبد والكلى) مما يحد من استخدامه ، خاصة في ممارسة طب الأطفال. بالنظر إلى هذه الميزة للدواء ، يتطلب استخدامه مراقبة يومية للتركيب الكمي للدم.
وفقًا لنتائج الدراسات العشوائية الحديثة ، تمتلك Foscarnet نشاطًا دوائيًا مضادًا للفيروسات كافياً ضد العامل المسبب لعدوى الفيروس المضخم للخلايا بجرعة يومية محسوبة تبلغ 90 مجم لكل كيلوغرام من وزن المريض. يُسمح أيضًا بالاستخدام المشترك لـ Foscranet مع الغلوبولين المناعي البشري المضخم للخلايا. من المفترض أن تستخدم جميع النساء اللواتي لديهن تاريخ توليدي متفاقم العقاقير المعدلة للمناعة مثل ليفاميزول لفترة طويلة في جرعة يومية 150 مجم عن طريق الفم ، T-Activin بجرعة يومية 1 ميكروجرام لكل كيلوجرام من وزن المريض ، تحت الجلد.
لا تتطلب عدوى الفيروس المضخم للخلايا ، التي تحدث في شكل يشبه عدد كريات الدم البيضاء ، استخدام أي علاج دوائي محدد.
تشمل النظم الحديثة لعلاج عدوى الفيروس المضخم للخلايا الاستخدام المشترك لعقار مضاد للفيروسات والإنترفيرون (Acyclovir بجرعة يومية 1000 مجم و a-interferon ، قطرتان في كل ممر أنفي خمس مرات في اليوم). يسمح نظام الأدوية هذا بعدم التحفيز المتبادل للتأثير المضاد للفيروسات ، وتقليل التأثير السام للأدوية المضادة للفيروسات. يشمل علاج عدوى الفيروس المضخم للخلايا عند الأطفال بالضرورة تعيين غلوبولين مناعي مضاد للفيروس المضخم للخلايا بجرعة 3 مل يوميًا في العضل لمدة 10 أيام.
عواقب عدوى الفيروس المضخم للخلايا
في غالبية المرضى ذات الأولوية ، لوحظ تطور مسار غير مصحوب بأعراض من عدوى الفيروس المضخم للخلايا ، وبعد ذلك ، في فترة النقاهة ، لوحظ استمرار الفيروس مدى الحياة في جسم الإنسان. عدوى الفيروس المضخم للخلايا لها عواقب سلبية للغاية على صحة المرضى الذين يعانون من مرض الإيدز وعدوى فيروس نقص المناعة البشرية ، والتي يمكن أن تسبب الوفاة.
على خلفية ضعف جهاز المناعة لدى البشر ، تتأثر جميع الأعضاء والهياكل الحيوية تقريبًا بتطور المضاعفات الالتهابية السائدة في شكل الالتهاب الرئوي والتهاب الدماغ والتهاب النخاع والتهاب القولون والتهاب القزحية والتهاب الشبكية والاعتلال العصبي.
في الحالة التي تتطور فيها عدوى الفيروس المضخم للخلايا لدى شخص بالغ يتمتع بصحة جيدة ، يكون تشخيص الحياة مناسبًا ، على الرغم من أنها تصبح لاحقًا حاملًا للفيروس وتشكل خطرًا وبائيًا على الآخرين. في المرضى الذين خضعوا لعملية زرع نخاع العظم ، في 70٪ من الحالات ، تؤدي عدوى الفيروس المضخم للخلايا إلى الإصابة بالالتهاب الرئوي الفيروسي ، والذي يتميز بتوقعات غير مواتية للغاية ومعدل وفيات مرتفع.
تجنب التطور عواقب سلبيةعدوى الفيروس المضخم للخلايا ، يمكنك استخدامها إجراءات إحتياطيه. لسوء الحظ ، لا يتم حاليًا تطبيق الوقاية المحددة من هذه الأمراض المعدية. وبالتالي ، فإن الرابط الأساسي في الوقاية من عدوى الفيروس المضخم للخلايا هو الاختيار الدقيق للمتبرعين بالدم ، الذين لا ينبغي أن توجد أجسامهم المضادة للفيروس المضخم للخلايا.
لأغراض وقائية ، يُظهر الأفراد المعرضون لخطر الإصابة بعدوى الفيروس المضخم للخلايا استخدام غلوبولين مناعي مفرط المناعة. في الحالة التي يكون فيها لدى المرأة طفل تظهر عليه علامات الإصابة بالفيروس المضخم للخلايا الخلقي ، يجب التخطيط لحالة ثانية في موعد لا يتجاوز عامين.
عدوى الفيروس المضخم للخلايا - الذي سيساعده الطبيب؟ إذا كان هناك أو يشتبه في تطور هذه الأمراض المعدية ، فيجب عليك طلب المشورة على الفور من أطباء مثل أخصائي الأمراض المعدية وطبيب الأطفال.
عدوى الفيروس المضخم للخلايا- هذا هو مرض فيروسي، حيث يحدث تكوين الخلايا العملاقة وتسلل الخلايا اللمفاوية في الأعضاء المصابة ، وهو مسار كامن في الأشخاص الطبيعيين جهاز المناعة، في الغالب عند الأطفال عمر مبكر.
المسببات.يشير CMV إلى فيروسات الهربس p (نوع فيروس الهربس 5). يحتوي الفيريون المحتوي على الحمض النووي على شكل كروي ، ويبلغ قطره 150-300 نانومتر. تُعرف ثلاث سلالات من الفيروس المضخم للخلايا: 169 م ، وديفيز وكير.
الفيروس المضخم للخلايا هو مدار للخلايا الظهارية (خاصة لظهارة الغدد اللعابية والأنابيب الكلوية) ، البطانة الوعائية ، الكريات البيض (الخلايا الليمفاوية ، الضامة والعدلات) ، الخلايا العملاقة ، الخلايا الليفية ، الخلايا العصبية ، الخلايا العصبية ، إلخ. في الخلايا المصابة ، ونتيجة لذلك تتحول إلى خلايا مضخمة للخلايا (CMC). هذه خلايا عملاقة (25-40 ميكرون) ذات نواة متضخمة ، تنتقل إلى السطح القاعدي ("عين البومة") ،
في عملية التكاثر الفيروسي ، يحدث التعبير عن المستضدات المبكرة (IEA) أولاً ، ثم المستضدات المتأخرة ، والتي تستخدم للتشخيص المصلي لمراحل المرض. يمكن أن يستمر الفيروس المضخم للخلايا في الخلايا لفترة طويلة مع إعادة التنشيط اللاحقة في ظل ظروف IDS. يحتل الفيروس المضخم للخلايا المرتبة الثانية بعد فيروس نقص المناعة البشرية من حيث النشاط المثبط للمناعة. مع CMVI ، يتطور نقص مناعي الخلايا التائية العميقة ، ويتم تنشيط التنشيط متعدد الخلايا للخلايا B ، والنشاط الوظيفي للبلاعم ، والخلايا القاتلة الطبيعية ، وإنتاج الإنترفيرون ، وحالة السيتوكين.
الفيروس غير مستقر في البيئة وحساس درجة حرارة عالية(عند 56 درجة مئوية تموت في غضون 10-20 دقيقة) ، والتجميد ، والتجفيف ، وعمل المطهرات القياسية والمذيبات العضوية.
الأسباب
يتميز CMVI بالتوزيع في كل مكان ، ونقص الموسمية وتفشي الأوبئة. في البلدان المتقدمة اقتصاديًا ، 0.5-2٪ من الأطفال حديثي الولادة ، و 10-30٪ من الأطفال في سن عام واحد ، و 40٪ من الأشخاص الذين تتراوح أعمارهم بين 35 عامًا وتقريبًا جميع السكان الذين تزيد أعمارهم عن 50 عامًا (95٪) مصابون بالعدوى. CMV. في البلدان ذات مستوى منخفضالتنمية الاجتماعية والاقتصادية والثقافة الصحية والصحية للسكان ، تحدث عدوى الفيروس المضخم للخلايا بشكل رئيسي في مرحلة الطفولة المبكرة. عدد كبير من الأشخاص الذين أطلقوا الفيروس في البيئة ، والعديد من طرق انتقاله ، ونقص التطعيم ، والعواقب السلبية كانت بمثابة الأساس لإدراج CMVI من قبل المكتب الأوروبي لمنظمة الصحة العالمية في مجموعة الأمراض التي تحدد مستقبل علم الأمراض المعدية في القرن ال 21.
المصدران هما المريض وناقل الفيروس. ما يقرب من 10 ٪ من الناس ، معظمهم من الأطفال الصغار ، يطلقون الفيروس المضخم للخلايا في البيئة. يوجد الفيروس في الدم ، والبول ، واللعاب ، والسائل الدمعي ، والمخاط البلعومي ، والسائل النخاعي ، والسائل المنوي ، وإفرازات عنق الرحم والمهبل ، وحليب الثدي ، والبراز. طرق انتقال الفيروس المضخم للخلايا - المحمولة جواً ، برازية الفم ، الاتصال ، بالحقن ، الجنسي ، الرأسي. يمكن أن تحدث العدوى فقط من خلال الاتصال الوثيق بمصدر العدوى ، وغالبًا ما تكون الأم بالنسبة للطفل.
يقع أول ارتفاع وبائي لمرض CMVI في وقت مبكر مرحلة الطفولة. غالبًا ما يتم تنفيذ الانتقال الرأسي في فترة ما قبل الولادة (95 ٪) ، وفي كثير من الأحيان - داخليًا (5 ٪). CMVI هو أكثر أنواع العدوى السابقة للولادة شيوعًا ويتم تشخيصه في 0.5-2٪ من الأطفال حديثي الولادة. في CMVI الأولي ، الذي يحدث أثناء الحمل في 2٪ من النساء ، يكون خطر الانتقال العمودي 30-50٪ ، و 10٪ من الأطفال تظهر عليهم أعراض CMVI الخلقي ، و 10-15٪ أخرى لديهم عواقب طويلة الأمد لعدوى ما قبل الولادة. مع إعادة تنشيط CMVI أثناء الحمل (20 ٪ من النساء) ، يكون تواتر الانتقال الرأسي للفيروس أقل بكثير (0.2-2 ٪) ، ويحدث المرض عند الأطفال بشكل أساسي في شكل كامن ، ولا يتم تسجيل العواقب طويلة المدى عمليًا . خلال الأشهر الأولى من الحياة ، يصاب الفيروس المضخم للخلايا لدى 5-30٪ من الأطفال. ما يقرب من 20 ٪ من الأمهات المرضعات إيجابيات المصل تفرز الفيروس المضخم للخلايا مع حليب الثدي واللعاب والبول والبراز وهي مصدر عدوى للأطفال. بعد بدء زيارة الأبناء مرحلة ما قبل المدرسةمصدر إصابة الطفل هو تساقط فيروسات الأطفال.
أما الارتفاع الوبائي الثاني فيحدث في سن المراهقة ، والذي يرتبط بانتقال الفيروس عن طريق الاتصال ("مرض التقبيل") والجهاز الجنسي.
طريقة تطور المرض. تعمل الأغشية المخاطية كبوابات دخول لـ CMV الجهاز التنفسي, السبيل الهضمي، الأعضاء التناسلية ، ملتحمة العين ، الجلد التالف.
يشمل التسبب في CMVI عدة مراحل.
1. إدخال العامل الممرض. عند مدخل بوابة الفيروس التغيرات المرضيةمفقود.
2. فيرميا. بمجرد وصول الفيروس إلى الدم ، يصيب الكريات البيض (الخلايا الليمفاوية ، الضامة ، العدلات) ويتكاثر فيها. اعتمادًا على حالة الجهاز المناعي ، يمكن الانتشار الدموي للفيروس أو استمراره على المدى الطويل.
3. تطور الالتهابات المصلية. في الأعضاء والأنسجة المصابة ، تتشكل الخلايا الجذعية السرطانية ، حيث يتكاثر الفيروس. في هذه الخلايا ، يتم تنشيط آليات تعطيل الفيروس المضخم للخلايا بسبب إنزيم الليزوزوم كاتاليز وإطلاق بروتين مخاطي يغلف الفيروس. ومع ذلك ، فإن آلية الدفاع الأخيرة ، على العكس من ذلك ، تساهم في "إخفاء" مستضدات الفيروس المضخم للخلايا من التعرف عليها من قبل خلايا الجهاز المناعي. في النهاية ، نتيجة لتكاثر الفيروس وإطلاق الفيروسات ، تموت CMC. في الأفراد الذين لديهم جهاز مناعة طبيعي ، يمكن أن يستمر الفيروس المضخم للخلايا لفترة طويلة في الخلايا المستهدفة دون موتهم.
4. تطور المضاعفات. تؤدي الخصائص المثبطة للمناعة لـ CMV والقدرة على تنشيط تكاثر الفيروسات الأخرى إلى ظهور عدوى مختلطة ، والعوامل المسببة لها هي البكتيريا ، ومسببات الأمراض داخل الخلايا (الكلاميديا ، والميكوبلازما) ، والفيروسات (بما في ذلك فيروسات الهربس الأخرى) ، والأوليات و الفطريات. يحدث تطور العدوى المختلطة مع النسخ المتماثل النشط لـ CMV في ظل ظروف IDS.
5. تشكيل مناعة محددة. في المراحل الأولية ، يلعب الدور الرائد في الحماية المضادة للعدوى عوامل المقاومة الفطرية - الضامة والخلايا القاتلة الطبيعية ونظام الإنترفيرون. تتطور استجابة مناعية محددة في وقت متأخر جدًا ، بعد 14-28 يومًا من إدخال العامل الممرض. ويرجع ذلك إلى ضعف المناعة وبطء تكاثر الفيروس المضخم للخلايا ، ونشاطه المثبط للمناعة ، والقدرة على التكاثر في خلايا الجهاز المناعي ، و "إخفاء" المستضدات الفيروسية بسر البروتين المخاطي ، وما إلى ذلك. من خلال الاستجابة المناعية من النوع الخلوي بمشاركة الخلايا الليمفاوية CD8 السامة للخلايا ، والتي تتغذى في بؤرة الالتهاب ، مما يؤدي إلى تكوين ارتشاح الخلايا اللمفاوية. في وقت لاحق ، نتيجة لتنشيط الخلايا الليفية ، يتشكل التليف والتكيس في موقع تسلل الخلايا اللمفاوية. وبالتالي ، فإن الثالوث المرضي المميز لـ CMVI يتضمن المظهر المتسلسل لـ CMB ، والتسلل اللمفاوي ، والتليف المثاني. الاستجابة المناعية للنوع الخلطي في CMVI أقل أهمية. ترتبط الأجسام المضادة لـ CMV بالفيروس الموجود خارج الخلية. تنتشر معقدات الأجسام المضادة للمستضد في الدم لفترة طويلة ، وتتراكم في الأنسجة وتتسبب في تلفها. بالإضافة إلى ذلك ، فإن الفيروس المضخم للخلايا يحفز إنتاج الأجسام المضادة الذاتية لخلايا الجسم المختلفة. المناعة في CMVI غير معقمة ، ولا تؤدي إلى القضاء على الفيروس الذي يبقى في الجسم مدى الحياة.
6. إعادة التنشيط في ظل ظروف IDS. يشير CMVI إلى الإصابات الانتهازية ، التي تحدث مظاهرها فقط في حالات IDS. بالإضافة إلى ذلك ، فإن جرعة ومسار انتقال العامل الممرض لهما أهمية كبيرة. في الأشخاص الذين يعانون من IDS الشديد أو عند الإصابة بجرعة كبيرة من الفيروس عن طريق الحقن ، يتطور شكل حاد من المرض ، والذي يمر عبر جميع مراحل التسبب في المرض المشار إليها. في الأشخاص الذين لديهم جهاز مناعة طبيعي ، مع جرعة معدية صغيرة ، يتم تكوين CMVI كامن ، ومع IDS المعتدل ، يتم تشكيل شكل مزمن من المرض. تحت تأثير العوامل المؤدية إلى تطوير IDS ، يحدث تنشيط CMV ، متبوعًا بتطور viremia وهزيمة الخلايا المستهدفة الجديدة.
التسبب في CMVI الخلقي له عدد من الميزات. يتسبب الفيروس في حدوث انتهاك لنمو وتكاثر الخلايا الجنينية والجنينية ، وله نشاط مطفر. بعيدا فعل مباشريتأثر الفيروس المضخم للخلايا سلبًا بالعوامل الوسيطة - اضطرابات التمثيل الغذائي لدى الأم المصابة بـ CMVI ، وارتفاع الحرارة ، ونقص الأكسجة ، وتطور التهاب المشيمة ، وما إلى ذلك. السنوات الاخيرةلقد ثبت أن العدوى السابقة للولادة بفيروس CMV تؤدي إلى تطوير التحمل المناعي - القضاء على استنساخ الخلايا الليمفاوية الخاصة بفيروس CMV وعدم القدرة على تكوين استجابة مناعية محددة. تلعب سمات الاستجابة الالتهابية للجنين والجنين دورًا مهمًا في التسبب في CMVI الخلقي. عند الإصابة في الأسبوعين الأولين من الحمل ، تحدث وفاة الجنين أو تتشكل أمراض جهازية ، على غرار الامراض الوراثية(اعتلال الأرومة). مع فترة الحمل من 3 إلى 10 أسابيع ، يكون للجنين مكون بديل فقط من الالتهاب ، مما يؤدي إلى اعتلال الجنين - تشوهات حقيقية على مستوى الأعضاء والخلية. في عمر الحمل من 11 إلى 28 أسبوعًا ، تسود المكونات البديلة والتكاثرية للالتهاب ، مما يؤدي إلى حدوث عيوب كاذبة مرتبطة بتشوه الأعضاء بالتصلب الكيسي (اعتلال الجنين المبكر). في عمر الحمل الذي يزيد عن 28 أسبوعًا ، يتميز التفاعل الالتهابي ليس فقط بالتكاثر البديل ، ولكن أيضًا بالمكونات النضحية ، وهو سبب تعميم العملية المعدية.
تصنيف
لم يتم تطوير التصنيف المقبول عمومًا لـ CMVI. في العمل العملي ، يمكنك استخدام إصدار العمل من تصنيف CMVI الذي اقترحه A.M. Ozhegov et al.
1. فترة الحدوث. داخل الرحم (خلقي). بعد الولادة (مكتسبة). 2. النموذج. المترجمة (التهاب الغدد اللعابية). معمم (التهاب السحايا ، التهاب الدماغ ، الالتهاب الرئوي ، التهاب القلب ، التهاب الكبد ، التهاب الكلية ، التهاب الأمعاء والقولون ، التهاب المشيمة والشبكية ، إلخ). المرحلة 3. نشيط. غير نشط. متبقي (بدون تكرار ، مع انتكاس ، مع عدوى). 4. التدفق. بَصِير. مزمن. كامن. 5. المضاعفات. يرتبط بتلف أجهزة الأعضاء. متلازمة مدينة دبي للإنترنت. نقص المناعة الثانوي. العدوى الثانوية الجرثومية والفيروسية والفطرية. 6. النتائج. استعادة. تلف الجهاز العصبي المركزي. الصمم وضعف البصر. التخلف في النمو الجسدي والعقلي. أمراض الأعضاء الداخلية المزمنة. فقر الدم ، فرفرية نقص الصفيحات ، قلة الصفيحات. نتيجة قاتلة.
أعراض
CMVI الخلقي. في العالم ، يولد 1.2 مليون طفل سنويًا بمرض CMVI الخلقي ، في الاتحاد الروسي - 75 ألفًا. في 90-95٪ من المرضى ، يستمر المرض في شكل كامن ، وفي 5-10٪ عند الولادة تظهر أعراض الأشكال المتبقية أو الحادة أو المزمنة للـ CMVI الخلقي.
عندما يصاب في أول 28 أسبوعًا من الحمل ، يولد الطفل بعيادة نموذجية متبقية. هناك تشوهات متعددة في القلب والجهاز العصبي المركزي والكلى والجهاز الهضمي وأجهزة الرؤية والسمع ، الجهاز العضلي الهيكلي. يولد الأطفال قبل الأوان ، وتظهر عليهم علامات تأخر النمو داخل الرحم. تتفاقم حالتهم بشكل تدريجي بسبب تفاقم الاضطرابات العصبية وسوء التغذية وإضافة عدوى مختلطة تكتسب مسارًا عامًا وغالبًا ما تؤدي إلى الوفاة.
شكل حاديتطور عند الإصابة عند عمر الحمل أكثر من 28 أسبوعًا. يتميز بمسار شديد وآفة عامة لأنظمة الأعضاء المختلفة ، ولكن قد يسود علم الأمراض المعزول. تحدث الأعراض بالفعل منذ لحظة الولادة ، ومع ذلك ، تظهر في بعض المرضى بحلول نهاية الأول - بداية اليوم الثاني من الحياة. تظهر أعراض التسمم (الحمى والخمول وفقدان الشهية وما إلى ذلك) ، ويمكن أن تستمر لمدة 2-6 أسابيع.
يتسبب الفيروس المضخم للخلايا (CMV) في اتجاه تقويضي لعمليات التمثيل الغذائي ، لذلك غالبًا ما يتم تسجيل متلازمة التمثيل الغذائي. يولد ثلث الأطفال بعلامات تأخر النمو داخل الرحم ، وفي المستقبل ، يعاني 50-70 ٪ من المرضى من ضعف في زيادة الوزن وتأخر النمو.
يُصاب ثلث الأطفال بالتهاب الدماغ والتهاب السحايا. يصيب الفيروس البطانة البطانية للبطينين والمنطقة المحيطة بالبطين في مادة الدماغ والضفائر المشيمية والأوعية الدموية. التغييرات في مادة الدماغ هي في طبيعة التهاب بيضاء الدماغ النخر المنتج مع تكوين الخراجات والتكلسات. أعراض التهاب الدماغ الفيروسي المضخم للخلايا والتهاب السحايا متعددة الأشكال ولا يتم التعبير عنها بوضوح دائمًا. في فترة حديثي الولادة ، القلق ، والخمول ، وضعف الوعي حتى الغيبوبة ، والاكتئاب أو غياب ردود الفعل عند الأطفال حديثي الولادة ، ونقص ضغط الدم وارتفاع ضغط الدم العضلي ، والشلل الجزئي ، والشلل ، وفرط الحركة ، وضعف المص ، والبلع ، والتنفس ، والحول ، وعدم تناسق الوجه ، والرأرأة ، والتشنجات ، لوحظت العلامات السحائية. غالبًا ما يتم تشخيص هؤلاء المرضى عن طريق الخطأ بإصابة الجهاز العصبي المركزي بنقص التأكسج. في المستقبل ، يتميز التهاب الدماغ الفيروسي المضخم للخلايا بمسار طويل متموج. في فترة حديثي الولادة ، تلعب متلازمة الاكتئاب دورًا رائدًا ، في عمر 1-2 شهر - اضطرابات حركية ، في عمر 2-6 أشهر - متلازمة ارتفاع ضغط الدم ، من 6 إلى 12 شهرًا - تأخر في النمو الحركي النفسي. في مخطط الخمور ، تم العثور على كثرة الخلايا الليمفاوية أو المختلطة وزيادة في محتوى البروتين ، ومع ذلك ، في بعض المرضى لا توجد تغييرات. عندما يتم فحصه بواسطة تصوير الأعصاب ، التصوير المقطعيوالرنين المغناطيسي النووي عند الأطفال حديثي الولادة في المناطق المحيطة بالبطين ، يصورون تورمًا في أنسجة المخ والمناطق ذات الكثافة المتزايدة. في عمر 1-3 أشهر ، توجد الأكياس في المنطقة المحيطة بالبطين ، وتوجد تكلسات في منطقة الأوعية والبطينين. بحلول 4-12 شهرًا ، ينضم ضمور مادة الدماغ ، وهو انتهاك لمعماريته وعلامات استسقاء الرأس. في 15 ٪ من المرضى ، نتيجة لتطور التهاب الأوعية الدموية التكاثري النضحي ، يحدث نزيف في الدماغ والفضاء تحت العنكبوتية.
منذ الأيام الأولى من الحياة ، يصاب 50-80٪ من المرضى باليرقان ، والذي يتميز بزيادة في غضون أسبوعين ، يليه انخفاض بطيء ومتموج على مدى شهر إلى ستة أشهر. يرتبط اليرقان بتطور التهاب الكبد الفيروسي المضخم للخلايا وزيادة انحلال الدم في خلايا الدم الحمراء. يتميز التهاب الكبد الفيروسي المضخم للخلايا (CMV) بالبداية السريعة لمتلازمة الركود الصفراوي. يتم تسجيل تضخم الكبد والطحال ، وتغير لون البول والبراز ، وفرط بيليروبين الدم بسبب الكسر المباشر ، وزيادة نشاط الترانساميناسات (حتى 2-5 معايير) ، والفوسفاتاز القلوي ، والكوليسترول. يؤدي تلف خلايا نخاع العظم إلى زيادة انحلال الدم في كريات الدم الحمراء. في هذه الحالة ، يستمر CMVI تحت "قناع" المرض الانحلالي لحديثي الولادة أو اليرقان المقترن أو اليرقان الفسيولوجي لفترات طويلة. يحتفظ البول والبراز بلونه المعتاد ، ويلاحظ فرط بيليروبين الدم بسبب الجزء غير المباشر مع نشاط الترانساميناز الطبيعي. مع تطور متلازمة الركود الصفراوي ، هناك زيادة معتدلة في نشاط الترانساميناسات (تصل إلى 1.5-2 معايير) والفوسفاتيز القلوي (ما يصل إلى 2-3 معايير).
يتم تسجيل متلازمة النزف في 65-80 ٪ من المرضى ، بسبب تلف البطانة الشعرية ، وتطور DIC ونقص الصفيحات بسبب تلف خلايا النواء الكبيرة. يتجلى ذلك من خلال نزيف في الجلد والأغشية المخاطية والدماغ والغدد الكظرية ، ونزيف من الأنف والجروح السرية ، والتقيؤ "القهوة" ، والطباشير وبيلة دموية.
يعاني غالبية المرضى (60-75٪) من تضخم الكبد والطحال ، والذي يتم تضمينه ، جنبًا إلى جنب مع اليرقان والطفح الجلدي النزفي ، في ثالوث الأعراض التي تجعل من الممكن الاشتباه في CMVI عند الأطفال في الأيام الأولى من الحياة. يصاب بعض المرضى بالتهاب رئوي خلالي ، والذي يحدث تحت "قناع" متلازمة اضطرابات الجهاز التنفسي (ضيق التنفس ، ضيق التنفس ، عدم انتظام التنفس ، انقطاع النفس). في فحص الأشعة السينيةالبحث عن التسلل الخلالي الثنائي وانتفاخ الرئة.
يُصاب ثلث المرضى بالتهاب الكلية الخلالي وتضخم الكبيبات ، والتي تتميز بظهور CMK في البول ، والبروتينية ، والبول الأسطواني ، وبيلة الكريات الحمر ، وبيلة الكريات البيض ، وزيادة في محتوى اليوريا والنيتروجين المتبقي في الدم.
يحدث التهاب المعدة والأمعاء القولوني المضخم للقولون لدى 30٪ من الأطفال ، وأعراضه هي القيء ، البراز السائلوالانتفاخ. تظهر القرحات في الأمعاء الغليظة عند بعض المرضى مما يؤدي إلى ظهور شوائب مرضية في البراز (مخاط ، دم) ، انثقاب والتهاب الصفاق. ربما تطور التهاب البنكرياس المضخم للخلايا ، والذي يحدث تحت "قناع" التليف الكيسي.
يتم تشخيص التهاب عضلة القلب والتهاب المشيمة والشبكية والتهاب العنبية في 10٪ من المرضى. يعاني جميع المرضى من التهاب الغدد اللعابية المضخم للخلايا ، ولكن في أغلب الأحيان يظل غير معترف به سريريًا. في بعض الأطفال ، يظهر طفح جلدي متعدد الأشكال ، حطاطي ، لطاخي حطاطي على الجلد دون توطين نموذجي.
في فحص الدم العام ، يتم الكشف عن فقر الدم الناقص الصبغي ، زيادة عدد الكريات البيضاء حتى تفاعل اللوكيميا أو قلة الكريات البيض ، قلة الصفيحات.
معدل الوفيات في CMVI الخلقي الحاد يتراوح من 5 إلى 30٪. 70-90٪ من الأطفال الباقين على قيد الحياة لديهم الآثار المتبقيةفي شكل صمم حسي عصبي ، عمى ، تخلف عقلي حاد ، طفولة الشلل الدماغيتليف الكبد التهاب البنكرياس المزمن، مرض الكلى المتعدد الكيسات ، تضيق الحالب ، موه الكلية ، إلخ.
شكل مزمنيتطور كنتيجة للـ CMVI الخلقي الحاد أو كعملية مزمنة أولية. يتميز بدورة طويلة مع تفاقمات دورية مرتبطة بتعميق IDS وإضافة عدوى مختلطة. كما هو الحال في الشكل الحاد ، تتميز الآفة بأعضاء متعددة ، ولكن يمكن أن تهيمن أمراض أي عضو. بالإضافة إلى ذلك ، خلال الأشهر الثلاثة إلى الستة الأولى من العمر ، يمنع وجود الأجسام المضادة للأم من انتشار العامل الممرض ، لذلك قد تكون الأعراض السريرية خفيفة ("فجوة مضيئة" ، "متلازمة CMV الخفية"). تؤدي هذه الظروف إلى التشخيص المتأخر للمرض.
تشمل أعراض CMVI الخلقي المزمن حالة فرط الحمى الطويلة وضعف زيادة الوزن. تشمل عيادة التهاب الدماغ المضخم للخلايا المزمن تأخرًا في التطور النفسي الحركي ، ومتلازمة ارتفاع ضغط الدم ، ومتلازمة استسقاء الرأس ، ومتلازمة الاضطرابات الحشوية الخضرية ، واضطرابات الهرمونات ، والأعراض البؤرية ، والضمور العصب البصري، فقدان السمع الحسي العصبي ، إلخ.
في كثير من الأحيان ، لوحظ اعتلال العقد اللمفية المعمم وتضخم الكبد والطحال. يصاب نصف المرضى بالتهاب الكبد الفيروسي المضخم للخلايا المزمن ، والذي يتميز بتضخم وتصلب الكبد ، وتضخم الطحال ، وزيادة نشاط الترانساميناسات ، وتطور نقص وبروتين الدم. ربما تكون تليف الكبد.
المرضى الذين يعانون من CMVI الخلقي المزمن ينتمون إلى مجموعة الأطفال المرضى بشكل متكرر. لديهم التهاب البلعوم الأنفي المتكرر ، والتهاب الحنجرة والقصبات ، والتهاب الشعب الهوائية الانسدادي ، والتهاب القصيبات ، والالتهاب الرئوي. في 25٪ من المرضى ، يحدث التهاب الحويضة والكلية والتغيرات الكيسية الليفية في الكلى. يظهر معظم الأطفال تغييرات في
الجهاز الهضمي - تم العثور على فقدان الشهية والقلس والقيء والبراز غير المستقر وانتفاخ البطن وعلامات دسباقتريوز الأمعاء وعسر البنكرياس. يصاب 10-15٪ من المرضى بالتهاب المشيمية والشبكية المزمن والتهاب العنبية ، مما يؤدي غالبًا إلى فقدان البصر. يحدث التهاب الغدد اللعابية في جميع المرضى ، ولكن من الناحية السريرية ، كقاعدة عامة ، لا يتم التعرف عليه. في فحص الدم العام ، يتم الكشف عن فقر الدم ونقص الصفيحات.
يحدث إعادة تنشيط CMVI الخلقي المزمن ، كقاعدة عامة ، في سن 3-6 أشهر ، والذي يرتبط بتقويض الأجسام المضادة للأم وإضافة العدوى المختلطة التي تسببها الفيروسات (بما في ذلك فيروسات الهربس) ومسببات الأمراض داخل الخلايا (الكلاميديا ، الميكوبلازما ) والبكتيريا والفطريات والأوليات. غالبًا ما يؤدي تكوين عدوى مختلطة على خلفية تعميق IDS إلى الموت.
الشكل الكامن هو الأكثر شيوعًا (90-95٪ من المرضى) ويتميز بغيابه أعراض مرضيةعند الولادة. في الوقت نفسه ، يمثل هؤلاء الأطفال مجموعة خطر للمسار غير المواتي للتداخل أمراض معدية. يمكن أن تستمر عملية إعادة تنشيط الفيروس المضخم للخلايا تحت "أقنعة" من حالة الحمى الفرعية الطويلة الأمد ، واعتلال العقد اللمفية ، والحادة عدوى الجهاز التنفسيفي 5-17٪ من الأطفال في سن ما قبل المدرسة وما دون سن الدراسةهناك عواقب طويلة المدى لعدوى ما قبل الولادة - التهاب المشيمة والشبكية ، والصمم ، والتخلف العقلي والكلامي ، والاضطرابات السلوكية ، وصعوبات التعلم ، وأمراض الكبد المزمنة ، وما إلى ذلك.
اكتسبت CMVI. تعتمد عيادة CMVI المكتسبة على عمر الطفل وحالة الحالة المناعية وطرق العدوى وجرعة الفيروس.
تم الحصول على CMVI من الرضعيحدث في كثير من الأحيان في شكل كامن. تظهر المظاهر السريرية في 20٪ من المرضى. ارتفاع درجة حرارة الجسم ، والخمول ، والنعاس ، والضعف ، والقلق ، والقيء ، والقلس ، وفقدان الشهية وزيادة الوزن ، والبراز غير المستقر ، وتضخم الغدد الليمفاوية ، والكبد ، والطحال ، والتهاب الغدد اللعابية ، والمتلازمة النزفية ، وأمراض الرئة (الالتهاب الرئوي ، والتهاب الشعب الهوائية ، والتهاب القصيبات) ، والكلى (التهاب الكلية ، التهاب الحويضة والكلية) ، الكبد (التهاب الكبد) ، الجهاز العصبي المركزي (التهاب الدماغ ، التهاب السحايا والدماغ) ، الجهاز الهضمي (التهاب الأمعاء والقولون) وفقر الدم. يتميز المرض بدورة متموجة مطولة. في حالة تطور العدوى المختلطة ، يمكن أن تكون النتيجة مميتة. في المستقبل ، ينضم كل من استسقاء الدماغ المجهري ، والشلل التشنجي ، وتأخر النمو الحركي النفسي ، والتهاب المشيمية والشبكية ، وإعتام عدسة العين ، وضمور العصب البصري.
يحدث CMVI المكتسب لدى الأطفال الأكبر سنًا أيضًا بشكل أساسي في شكل كامن. يحدث التنشيط بدون أعراض أو يكون مصحوبًا بعيادة من الحمى منخفضة الدرجة ، واعتلال العقد اللمفية ، ونزلات الجهاز التنفسي العلوي ، وما إلى ذلك. هؤلاء المرضى لديهم مسار أكثر حدة من الأمراض المعدية المتداخلة.
يتطور الشكل الحاد ، كقاعدة عامة ، في ظروف IDS أو عند نقل الدم المصاب. تتراوح فترة الحضانة من 15 يومًا إلى 3 أشهر. تشمل الأشكال الموضعية التهاب الغدد اللعابية والمتلازمة الشبيهة بالإنفلونزا والتهاب الكبد. وتجدر الإشارة إلى أنه من وجهة نظر الإمراضية ، فإن عزلهم مشروط إلى حد ما. تتميز الأشكال المعممة ببداية حادة وأعراض شديدة للتسمم وآفات أعضاء متعددة. وهي تشمل متلازمة شبيهة بعدد كريات الدم البيضاء ، وتلف الرئتين ، والجهاز العصبي المركزي ، والكلى ، والكبد ، والجهاز الهضمي ، وما إلى ذلك.
مع التهاب الغدد اللعابية المضخم للخلايا ، ترتفع درجة حرارة الجسم ، تظهر أعراض تسمم واضحة بشكل معتدل ، زيادة ووجع في الغدد اللعابية (غالبًا ما تكون الغدة النكفية ، وغالبًا ما تكون تحت الفك السفلي وتحت اللسان). في المستقبل ، يكتسب التهاب الغدد اللعابية مسار مزمنويصاحبه تليف في الغدد اللعابية.
تتطور المتلازمة الشبيهة بداء كثرة الوحيدات بشكل رئيسي عند الأطفال دون سن الثالثة. يبدأ المرض بارتفاع في درجة حرارة الجسم إلى أرقام تحت الحمى وظهور أعراض التسمم ، والتي يمكن أن تستمر لمدة أسبوعين أو أكثر. في ثلث المرضى ، تكون درجة حرارة الجسم حموية. هناك زيادة جهازية في الغدد الليمفاوية ، وخاصة عنق الرحم الأمامي. لا تصل الغدد الليمفاوية في معظم الأطفال (70٪) مقاسات كبيرة(ميكروبولاديدينيا). تم تسجيل تضخم الكبد والطحال في 40٪ من المرضى. غالبًا ما يكون لالتهاب اللوزتين طابع نزفي ، وهناك علامات على التهاب الغدد. الطفح الجلدي متعدد الأشكال ذو الطبيعة البقعية والحطاطية والحطاطية نادر جدًا. قد تتضخم الغدد اللعابية. تظهر اختبارات الدم كثرة اللمفاويات و الخلايا أحادية النواة غير النمطية.
يصاحب الالتهاب الرئوي الفيروسي المضخم للخلايا زيادة في درجة حرارة الجسم ، وظهور سعال غير منتج شبيه بالسعال الديكي ، وضيق في التنفس وزراق. البيانات المادية نادرة نوعًا ما. يصاب بعض المرضى بالتهاب الشعب الهوائية الانسدادي.
تحدث هزيمة الجهاز العصبي المركزي في شكل التهاب السحايا والدماغ ، وأعراضه السريرية هي ضعف الوعي ، أمراض عقلية، تشنجات ، تشنج نصفي وخزل سفلي ، علامات سحائية. المرضى الذين يعانون من IDS قد يصابون باعتلال الدماغ والنخاع ، واعتلال النخاع الشوكي ، واعتلال الجذور العصبية.
الأعراض السريرية لالتهاب الكلية الفيروسي المضخم للخلايا عادة ما تكون غائبة. أظهر تحليل البول CMB ، بروتينية ، أسطوانية ، عدد كبير منظهارة.
يحدث تلف الكبد على شكل التهاب الكبد تحت الحاد مع متلازمة الركود الصفراوي. على خلفية أعراض التسمم ، تظهر اليرقان المعتدل وتضخم الكبد والطحال. لوحظ فرط بيليروبين الدم بسبب الكسر المباشر ، زيادة في نشاط الترانساميناسات ، الفوسفاتاز القلوي ، وزيادة الكوليسترول.
عندما يتأثر الجهاز الهضمي ، يحدث انتفاخ في البطن ، وقيء مستمر ، وبراز رخو دون شوائب مرضية ، وفقدان الوزن. في المعدة والأمعاء ، يمكن أن تتشكل القرحات ، مما يؤدي إلى انثقاب وتطور التهاب الصفاق. بسبب التنكس الكيسي والخلل الوظيفي للبنكرياس ، تظهر كمية كبيرة من الدهون المحايدة في مخطط البروتين.
غالبًا ما يحدث الشكل المزمن تحت "أقنعة" التهاب الشعب الهوائية الانسدادي المتكرر ، والالتهاب الرئوي المزمن ، والتهاب الغدد اللعابية المزمن ، والتهاب الكبد ، والتهاب البنكرياس ، والتهاب الكلية ، والتهاب المعدة ، والتهاب الأمعاء والقولون ، وخلل التوتر العضلي الوعائي ، ومتلازمة العجز العضلي ، وما إلى ذلك.
التشخيص
يعتمد تشخيص CMVI على مراعاة بيانات تاريخ الوباء (مجموعة الخطر) والأعراض السريرية والفحص الإضافي. يشمل التشخيص المختبري ثلاث مجموعات من الأساليب.
1. الكشف عن الفيروس المضخم للخلايا والحمض النووي الخاص به.
الطريقة الفيروسية هي "المعيار الذهبي" للاختبارات المعملية. المواد هي الدم ، والبول ، واللعاب ، والسائل النخاعي ، ومخاط عنق الرحم ، والسائل الأمنيوسي ، والسائل المنوي ، وعينات الأنسجة. تشمل العيوب كثافة اليد العاملة ومدتها (2-3 أسابيع). . طريقة الاستزراع السريع (فحص قنينة الصدفة) خيار الطريقة الفيروسية، بعد 6 ساعات من الإصابة بزرع الخلية ، يتم الكشف المبكر عن مستضدات الفيروس المضخم للخلايا باستخدام الأجسام المضادة وحيدة النسيلة. . يسمح تفاعل البلمرة المتسلسل (PCR) باكتشاف الحمض النووي للفيروس في المواد البيولوجية المختلفة. يسمح لك MBTod Real-time PCR (PCR في الوقت الحقيقي) بتحديد عيار الفيروس في السوائل البيولوجية والخلايا وعينات الخزعة. في المرضى المصابين بعدوى فيروس العوز المناعي البشري ، مؤشرات نشاط الفيروس المضخم للخلايا هي الحمل الفيروسي للدم لأكثر من 10 4 نسخ من الحمض النووي في 1 مل من البلازما وأكثر من 10 3 نسخ من الحمض النووي في 100 ألف خلية بيضاء.
2. تحديد دلالات استجابة مناعية خلطية معينة. يسمح لك اختبار الممتز المناعي المرتبط بالإنزيم (ELISA) بتحديد الأجسام المضادة لفئتي IgM و IgG بشكل منفصل ، بما في ذلك المستضدات المبكرة (IEA) ومستضدات CMV المتأخرة ، بالإضافة إلى شغف الأجسام المضادة IgG. تظهر الأجسام المضادة لفئة IgM بعد 7 أيام من الإصابة الأولية أو إعادة تنشيط الفيروس المضخم للخلايا. مع العدوى الأولية ، يزداد عيارها في غضون شهرين ، وبحلول 10 أشهر ، تختفي الأجسام المضادة من فئة IgM. مع إعادة التنشيط ، تختفي الأجسام المضادة لفئة IgM في وقت أقصر. يبدأ إنتاج الأجسام المضادة لفئة IgG من 3-4 أسابيع مع CMVI الأولي وبعد أسبوعين من إعادة تنشيطه. حاليًا ، تم تطوير أنظمة الاختبار لتوصيف شغف الأجسام المضادة من فئة IgG (قوة ارتباط المستضد والأجسام المضادة). تدل الأجسام المضادة المنخفضة الشغف (مؤشر الشغف أقل من 30٪) على الإصابة الأولية المبكرة. يشير العيار المرتفع من IgG المتعطش (مؤشر الشغف 31-49٪) إلى إصابة أولية متأخرة. تشير الشغف العالي لـ IgG (مؤشر الجاذبية لأكثر من 50٪) ، مع مراعاة العيار ، إلى وجود كامن أو عدوى مزمنة. يتم أيضًا إنتاج أنظمة الاختبار التي تسمح باكتشاف الأجسام المضادة IgM و IgG لمولدات المضادات الفيروسية (1EA) الفورية المبكرة والمتأخرة. يشير وجود الأجسام المضادة IgM و IgG لبروتينات CMV الفورية المبكرة إلى تكاثر الفيروس النشط. لتشخيص التهاب الدماغ الفيروسي المضخم للخلايا ، تم تطوير أنظمة اختبار لتحديد التركيب داخل القراب للأجسام المضادة من فئة IgG.
3. تحديد علامات التأثير الممرض للخلايا للفيروس. غالبًا ما تستخدم الطريقة الخلوية للكشف عن CMC في البول واللعاب ، وغالبًا ما يكون ذلك في السائل النخاعي وحليب الثدي وعصير المعدة والسائل المنوي ومخاط عنق الرحم. حساسية الطريقة منخفضة جدًا (50٪) ، لذلك يوصى بتكرار الدراسة خلال 3-4 أيام. تستخدم حاليًا كطريقة تشخيص مساعدة. يشير اكتشاف CMB في المواد البيولوجية إلى تكاثر نشط للفيروس.
مع الأخذ في الاعتبار الاستجابة المناعية الضعيفة في CMVI ، يجب إجراء التشخيص المختبري باستخدام مجموعتين على الأقل من الاختبارات المعملية - الكشف عن الفيروس المضخم للخلايا ، والحمض النووي الخاص به ، واكتشاف الأجسام المضادة المحددة. المجموعة الأولى من الأساليب لها قيمة تشخيصية أعلى ، حيث يمكن اكتشاف الفيروس نفسه وحمضه النووي قبل ظهور الأعراض السريرية أو في وقت واحد معها. تتطور استجابة مناعية محددة مواعيد متأخرةوليس دائما كافيا. بالإضافة إلى التشخيص الفعلي لـ CMVI ، يهدف الفحص المخبري إلى تحديد نشاط العملية المعدية.
يجب إجراء التشخيص المختبري للـ CMVI الخلقي في الأسبوعين الأولين من العمر ، حيث لا يمكن استبعاد العدوى أثناء الولادة وبعدها في تاريخ لاحق.
عند تفسير نتائج الكشف عن الفيروس والحمض النووي الخاص به ، يجب أن نتذكر أن الفيروس المضخم للخلايا يختفي من الدم بسرعة كبيرة ، ولكن يمكن عزله عن الوسائط البيولوجية الأخرى لفترة طويلة.
التشخيص المصلي للـ CMVI الخلقي صعب للغاية. هذا يرجع إلى حقيقة أن الأجسام المضادة للأم من فئة IgG تنتشر في الطفل خلال الأشهر 3-6 الأولى من الحياة. يبلغ عمر النصف لـ IgG 21 يومًا ، لذلك خلال الأسابيع الثلاثة إلى الأربعة الأولى من العمر ، ينخفض عيار هذه الأجسام المضادة بمقدار مرة ونصف إلى مرتين. بسبب ظاهرة التحمل المناعي ، قد ينخفض إنتاج الأجسام المضادة الخاصة عند الأطفال. في 35٪ من الأطفال المصابين بفيروس CMVI الخلقي ، تكون الأجسام المضادة IgM غائبة عند الولادة ولا تظهر إلا في عمر أكثر من شهر واحد من العمر.
يجب اتباع القواعد التالية للفحص المصلي:
في حالة الاشتباه في حدوث CMVI الخلقي ، يجب فحص الطفل في الأسبوعين الأولين من الحياة. . حتى سن ستة أشهر ، يتم فحص والدته مع الطفل في نفس الوقت. . يجب إجراء الفحص قبل تناول منتجات الدم. . من الضروري تكرار تحديد عيار الجسم المضاد على فترات تتراوح من أسبوعين إلى ثلاثة أسابيع في نفس المختبر باستخدام نفس الطرق والكواشف. . المقارنات السريرية والمخبرية مطلوبة.
معايير التشخيص المختبري CMVI الخلقي:
الكشف عن الفيروس المضخم للخلايا وحمضه النووي في الدم أو السوائل البيولوجية الأخرى. . الكشف عن الأجسام المضادة لفئة IgM (بما في ذلك المستضد المبكر) ، فإن عيار الأجسام المضادة IgG في الطفل أكبر بأربع مرات من الأجسام المضادة للأم ، وزيادة في عيار إجمالي IgG ، و IgG منخفض الشغوف ، و IgG إلى مستضد مبكر مبكر في الديناميات بأربع مرات أو أكثر. معايير المختبر لنشاط CMVI الخلقي. . الكشف عن الفيروس المضخم للخلايا وحمضه النووي في الدم والسائل النخاعي. . الكشف عن الأجسام المضادة لفئة IgM (بما في ذلك المستضد المبكر) ، فإن عيار الأجسام المضادة IgG في الطفل أكبر بأربع مرات من الأجسام المضادة للأم ، وزيادة في عيار إجمالي IgG ، و IgG منخفض الشغوف ، و IgG إلى مستضد مبكر مبكر في الديناميات بأربع مرات أو أكثر.
يتم عرض معايير التشخيص المختبري لـ CMVI المكتسبة ، وتحديد مرحلة المرض ونشاط العملية المعدية في الجدول.
| أمراض معدية | امراض غير معدية |
| متلازمة تورش | |
| . داء المقوسات الخلقي الحصبة الألمانية الخلقية IPG الخلقي خلقي حُماق الكلاميديا الخلقية داء المفطورات الخلقي خلقي عدوى الفيروس المعوي داء الليستريات الخلقي الزهري الخلقي ، إلخ. | . علم الأمراض الوراثي التشوهات الخلقية تحت تأثير الإشعاع المؤين ، الأدوية ، العوامل السامة ، إلخ. |
متلازمة التهاب الغدد اللعابية |
|
| . التهاب الغدة النكفية التهاب الغدد اللعابية صديدي (ثانوي) النكاف في الإصابة بفيروس نقص المناعة البشرية السل الغدد اللعابية داء الشعيات في الغدد اللعابية | . متلازمة ميكوليتش في ابيضاض الدم الحاد التهاب الغدة النكفية التحسسي المتكرر ورم الغدد اللعابية مرض الحصيات اللعابية |
متلازمة تشبه داء كثرة الوحيدات |
|
| . عدوى فيروس ابشتاين بار عدوى الهربس البسيط عدوى فيروس الهربس البشري من النوع 6 عدوى فيروس الهربس البشري من النوع 7 عدوى الفيروس الغدي عدوى فيروس نقص المناعة البشرية داء المقوسات الكلاميديا اليرسينية الليستريات التولاريميا داء البروسيلات | . مرض الدرن أمراض الأورام(ابيضاض الدم ، ورم الحبيبات اللمفاوية ، أورام الغدد الليمفاوية ، كثرة المنسجات) |
مع الأخذ في الاعتبار النشاط المثبط للمناعة لـ CMV ، من الضروري تضمين دراسة الحالة المناعية في مجمع الفحص. يكشف الرسم المناعي عن انخفاض في عدد الخلايا الليمفاوية التائية (CD3) وتكاثرها استجابةً للميتوجينات ، وانعكاس مؤشر التنظيم المناعي CD4 / CD8 بسبب انخفاض في T-helpers (CD4) وزيادة في T- السامة للخلايا الخلايا الليمفاوية (CD8) ، تنشيط متعدد الخلايا للخلايا الليمفاوية B (CD20) ، والذي يصاحبه فرط أو نقص غلوبولين الدم ، انخفاض في النشاط الوظيفي للبلاعم ، العدلات ، انخفاض في عدد الخلايا القاتلة الطبيعية (CD16) ، الإنتاج من الانترلوكينات (IL-1 ، IL-2) والانترفيرون.
تشخيص متباين. مجموعة متنوعة من الأعراض السريرية لـ CMVI تملي الحاجة تشخيص متباينمع مجموعة واسعة من المعدية و امراض غير معديةمع الأخذ بعين الاعتبار الرائد متلازمة سريرية. مع CMVI الخلقي ، المرض الرائد هو متلازمة TORCH ، مع CMVI المكتسب - "متلازمة التهاب Syladenitis" و "متلازمة تشبه عدد كريات الدم البيضاء الحادة".
علاج او معاملة
علاج CMVI هو علاج مرحلي ومعقد ، ويتضمن نظامًا ونظامًا غذائيًا وعلاجًا موجهًا للسبب والأمراض ومسببًا للأعراض. يتم الاستشفاء مع مراعاة شدة المرض. توصف الراحة في الفراش لفترة شدة الحالة. يجب أن تكون التغذية الطبية متوازنة من حيث المكونات الرئيسية ، بما في ذلك الفيتامينات والعناصر النزرة.
مؤشرات لتعيين العلاج موجه للسبب هي المؤشرات السريرية والمخبرية لنشاط CMVI. لعلاج CMVI ، يتم استخدام عدة مجموعات من الأدوية المسببة للسبب ، ويعتمد اختيارها على شكل المرض.
1. الأدوية القاتلة للفيروسات - نوكليوسيدات غير طبيعية (غانسيكلوفير ، أسيكلوفير ، فالاسيكلوفير ، فامسيكلوفير) ، فوسكارنيت ، إينوزين برانوبكس ، أربيدول. Ganciclovir (Cymeven) لديه أعلى نشاط ضد الفيروس المضخم للخلايا. مؤشرات تعيينه هي أشكال عامة من CMVI ، بالإضافة إلى أشكال مترجمة مع مسار شديد ومعقد. يتم إعطاء الدواء عن طريق الوريد بالتنقيط لمدة 2-3 أسابيع ، ثم يتم تحويله إلى علاج الصيانة. غالبًا ما تكون هناك آثار جانبية - فقر الدم ، قلة العدلات ، قلة الصفيحات ، زيادة كرياتينين المصل ، التهاب البنكرياس التفاعليفوسكارنت مثبط لبوليميراز الدنا الفيروسي. مؤشرات الإدارة مماثلة لتلك الخاصة بـ ganciclovir. يتم إعطاؤه عن طريق الوريد بالتنقيط لمدة 10-14 يومًا. غالبًا ما يتسبب في ظهور آثار جانبية (فقر الدم ، قلة العدلات ، قلة الصفيحات ، إلخ) ، لا تخترق الحاجز الدموي الدماغي. في علم الأمراض الوخيم (الالتهاب الرئوي المضخم للخلايا لدى الأشخاص المصابين بـ IDS) ، يوصى باستخدام foscarnet مع ganciclovir. يمنع Inosine pranobex تكرار CMV عن طريق الارتباط بالريبوسوم الخلوي وتغيير هيكله الكيميائي الفراغي. الدواء فعال ضد فيروسات DNA و RNA الأخرى ، وله نشاط مناعي - يعزز تكاثر الخلايا اللمفاوية التائية ، وخلايا T- القاتلة الطبيعية ، ويحفز النشاط الوظيفي للخلايا اللمفاوية التائية ، وإنتاج الإنترلوكينات ، والأجسام المضادة ، ويزيد من النشاط الكيميائي والنشاط البلعمي للخلايا الضامة والعدلات. خفيف ومتوسط أشكال شديدةيتم وصف isoprinosine (inosine pranobex) بجرعة 50-100 مجم / كجم / يوم في 3-4 جرعات لمدة 7-10 أيام ، في أشكال حادة - 10-15 يومًا. إذا لزم الأمر ، اقض دورتين إضافيتين بفاصل 7-10 أيام. يستخدم Valaciclovir (Valtrex) في الأطفال الذين تزيد أعمارهم عن 12 عامًا لمنع إعادة تنشيط CMVI بعد الزرع. يتم تناول الدواء عن طريق الفم لمدة ثلاثة أشهر. حساسية الفيروس المضخم للخلايا للنيوكليوسيدات غير الطبيعية الأخرى (الأسيكلوفير ، فامسيكلوفير) منخفضة. تم إثبات فعالية arbidol في علاج عدد كريات الدم البيضاء CMV لدى الأطفال. يوصف الدواء بجرعة عمرية لمدة 7 أيام ، ثم مرتين في الأسبوع لمدة 4 أسابيع.
2. الغلوبولين المناعي. Neocytotec هو غلوبولين مناعي بشري يحتوي على نسبة متزايدة من الأجسام المضادة ضد الفيروس المضخم للخلايا. يتم استخدام الدواء في أشكال عامة من CMVI ، وكذلك في أشكال موضعية مع مسار شديد ومعقد. يُعطى Neocytotec عن طريق الوريد بالتنقيط مرة كل يومين حتى تختفي أعراض المرض. الدواء خالي من الآثار الجانبية المميزة لـ ganciclovir و foscarnet. استخدم الغلوبولين المناعي الأخرى للإعطاء عن طريق الوريد (ساندوغلوبولين ، بنتاجلوبين ، مناعي ، إينتراغلوبين ، إينتراكتكت ، إلخ). في الأشكال الخفيفة ، يتم وصف مستحضر الغلوبولين المناعي المعقد (CIP) عن طريق الفم.
3. الإنترفيرون. تستخدم الإنترفيرون مع الأدوية المبيدة للفيروسات والغلوبولين المناعي. يتم وصف الإنترفيرون للحقن العضلي (ريفيرون ، ريالديرون ، روفيرون أ ، إنترون أ ، إلخ) للأطفال الذين تزيد أعمارهم عن عامين بأشكال معممة من فيروس التهاب الكبد الوبائي ، وكذلك مع مسار شديد ومعقد للأشكال الموضعية. يتم إعطاء الأدوية عن طريق الحقن العضلي بجرعة 500 ألف - 2 مليون وحدة دولية مرة واحدة يوميًا لمدة 10-14 يومًا ، ثم 3 مرات في الأسبوع لمدة 3-6 أشهر أو يتم نقل المريض إلى علاج الصيانة باستخدام viferon reaferon-EC-lipint أو genferon-light تحت سيطرة المعلمات السريرية والمخبرية. يتم إعطاء Viferon لعلاج CMVI الخلقي عن طريق المستقيم مرتين يوميًا لمدة 10 أيام ، ثم ينتقلون إلى علاج الصيانة مرتين في اليوم كل يوم لمدة 3-6 أشهر. يتم وصف تحاميل Viferon-1 1 للأطفال الذين تقل أعمارهم عن شهرين مرتين في اليوم ، من 2 إلى 4 أشهر - تحاميل Viferon-1 2 في الصباح وتحميلة واحدة في المساء ، من 4 إلى 6 أشهر - Viferon-1 2 التحاميل مرتين في اليوم ، أكبر من 6 أشهر - Viferon-2 ، تحميلة واحدة مرتين في اليوم. لعلاج CMVI المكتسب لدى الأطفال الذين تقل أعمارهم عن 7 سنوات ، يتم استخدام Viferon-1 ، وأكبر من 7 سنوات - Viferon-2. يوصف الدواء تحميلة واحدة مرتين في اليوم لمدة 10 أيام ، ثم تحميلة واحدة مرتين في اليوم 3 مرات في الأسبوع لمدة 1-6 أشهر تحت سيطرة المعايير السريرية والمخبرية. جرعة واحدة من ضوء Genferon في شكل التحاميل الشرجيةفي الأطفال دون سن 7 سنوات هو 125 ألف أنا ، فوق 7 سنوات - 250 ألف لي. بدء العلاج - تحميلة واحدة مرتين في اليوم لمدة 10 أيام ، علاج الصيانة - تحميلة واحدة في الليل كل يومين لمدة 1-3 أشهر. يُوصف ريفيرون-إي سي-ليبينت في التهاب الكبد الوبائي الخلقي المعمم والتهاب الكبد الفيروسي المضخم للخلايا للأطفال الأكبر من 5 سنوات بجرعة 3 ملايين وحدة / م 2 عن طريق الفم مرتين يوميًا لمدة 10 أيام ، ثم مرة واحدة يوميًا لمدة 3 أشهر.
4. يُشار إلى محرضات الإنترفيرون (نيوفير ، سيكلوفيرون ، أنافيرون ، كاغوسيل ، أميكسين) كعلاج أولي بالاشتراك مع الأدوية القاتلة للفيروسات بأشكال خفيفة ومتوسطة ، كعلاج صيانة بعد دورة من الأدوية القاتلة للفيروسات والإنترفيرون. يتم وصف الأدوية وفقًا لمخططات مطولة.
5. تستخدم المضادات الحيوية أثناء التطوير الالتهابات البكتيرية. تستخدم aminopenicillins المحمية ، السيفالوسبورينات من الجيل الثالث والرابع ، الماكروليدات ، carbapenems.
يشمل العلاج الممرض تعيين مُعدِّلات المناعة (ثيمالين ، تاكتيفين ، ثيموجين ، إيمونوفان ، بولي أوكسيدونيوم ، ليكوبيد ، إيمونوريكس ، ديرينات ، نيوكليينات الصوديوم ، نيوبوجين ، IRS-19 ، ريبومونيل ، قصبي ، مناعي ، إلخ) ومستحضرات السيتوكين. تحت السيطرة المناعية. قم بإجراء علاج لإزالة السموم. موصى به للأشكال الخفيفة إلى المعتدلة شراب وفير، وفي حالة الحقن المعمم والشديد والمعقد - بالتنقيط الوريدي لمحاليل الجلوكوز والملح. لغرض إزالة السموم بأشكال خفيفة ومتوسطة ، يتم استخدام مواد الامتصاص المعوية (smecta ، filtrum ، enterosgel ، إلخ) ، في أشكال شديدة ومعقدة ، يتم استخدام طرق إزالة السموم خارج الكلية (امتصاص الدم ، فصل البلازما). يوصف للمرضى الفيتامينات المتعددة ومجمعات الفيتامينات المعدنية ، وأدوية العلاج الأيضي (ريبوكسين ، كوكاربوكسيلاز ، سيتوكروم سي ، إلكار ، إلخ) ، البروبيوتيك (ثنائي الشكل ، لينكس ، بيفيدوم-بكتيرين-فورتي) ، محولات النبات. تستخدم حسب المؤشرات مضادات الهيستامين، مثبطات الأنزيم البروتيني ، cerebro- و angioprotectors ، العلاج بالأكسجين. يتم إجراء العلاج الممرض لأشكال محددة من أمراض الأنف (التهاب الدماغ والالتهاب الرئوي والتهاب الكبد والتهاب البنكرياس والتهاب القلب) وفقًا للقواعد العامة.
يشمل علاج الأعراض تعيين الأدوية الخافضة للحرارة وجليكوسيدات القلب وما إلى ذلك.
إعادة تأهيل
يتم الإشراف على المستوصف من قبل طبيب أطفال المنطقة وأخصائي الأمراض المعدية. المرضى الذين يعانون من CMVI الخلقي والأطفال المعرضين للخطر الذين ولدوا من النساء المصابات بـ CMVI والأمهات اللواتي لديهن تاريخ توليدي متفاقم يحتاجون إلى مراقبة المستوصف. تتم ملاحظة المرضى الذين يعانون من CMVI الخلقي الحاد والأطفال المعرضين للخطر لمدة عام واحد ، والمرضى الذين يعانون من CMVI المزمن - في غضون ثلاث سنوات بعد مغفرة مستقرة ، والأطفال الذين يعانون من الشكل المتبقي - حتى مرحلة المراهقة. تُجرى الامتحانات في سن 1 و 3 و 6 و 12 شهرًا من العمر ، ثم مرة كل ستة أشهر. يشمل الفحص فحصًا سريريًا ، وفقًا للإشارات - استشارات الأخصائيين (طبيب أعصاب ، طبيب مختص بالجهاز الهضمي ، أخصائي أمراض الدم ، أخصائي أمراض الكلى ، أخصائي أمراض الرئة ، طبيب عيون ، طبيب أسنان ، طبيب قلب ، اختصاصي مناعة ، إلخ). إجراء الفحص المعملي التحليل العامالدم والبول وعلامات CMVI بواسطة ELISA و PCR والبول واللعاب لـ CMB ، مناعي ؛ وفقًا للإشارات - اختبار دم كيميائي حيوي ، علامات HSV ، EBV ، VVZ ، HHV-6 ، HHV-7 ، التوكسوبلازما ، الكلاميديا ، الميكوبلازما بواسطة طرق ELISA و PCR ، الفحص البكتريولوجي. إذا لزم الأمر ، يتم إجراء فحص فعال - فحص قاع العين والموجات فوق الصوتية للأعضاء تجويف البطن، تصوير الأعصاب ، تصوير دوبلر ، التصوير المقطعي المحوسب والتصوير بالرنين المغناطيسي للدماغ ، تخطيط كهربية الدماغ ، تخطيط الدماغ ، مخطط السمع ، إلخ.
يشمل علاج إعادة التأهيل نظامًا وقائيًا ونظامًا غذائيًا متوازنًا غنيًا بالفيتامينات والعناصر الدقيقة. يتم وصف الإنترفيرون (viferon ، reaferon-EC-lipint) وفقًا لخطة علاج الصيانة ، محرضات الإنترفيرون (cycloferon ، neovir ، amixin ، anaferon) وفقًا لمخططات مطولة تحت سيطرة المعلمات السريرية والمخبرية. نوصي بتناول الفيتامينات المتعددة ومجمعات الفيتامينات المعدنية وعقاقير العلاج الأيضي والبروبيوتيك. تستخدم أجهزة المناعة تحت سيطرة أجهزة المناعة.
الوقاية
لم يتم ترخيص لقاحات الفيروس المضخم للخلايا للأمان ، لذا فإن الوقاية غير النوعية لها أهمية قصوى. يتم الوقاية من CMVI الخلقي في مراحل ما قبل الحمل والحمل وما بعد الولادة. تُنصح النساء المرضعات اللاتي يتخلصن من الفيروسات بالالتزام الصارم بقواعد النظافة الشخصية عند رعاية الأطفال ، ورفضها الرضاعة الطبيعيةأو إطعام طفلك حليب الثدي المبستر على درجة حرارة 72 درجة مئوية لمدة 30 ثانية. تتمثل الوقاية غير المحددة لـ CMVI المكتسبة في مراعاة قواعد النظافة الشخصية والنظام الصحي ومكافحة الوباء عند ملامسة المريض بشكل واضح من CMVI أو سقيفة الفيروس. من الضروري فحص الدم والمتبرعين بالأعضاء ، وتقليل مؤشرات عمليات نقل الدم ، وغسل كريات الدم الحمراء. يتم استخدام Cytotect و ganciclovir و foscarnet و valaciclovir لمنع إعادة تنشيط CMVI في متلقي الزرع. يتم تسهيل منع انتقال الفيروس المضخم للخلايا من خلال التثقيف الأخلاقي للمراهقين ، والدعاية أسلوب حياة صحيالحياة وتجنب المخدرات.
تم إصلاح عدوى الفيروس المضخم للخلايا في ما يقرب من 70 ٪ من السكان وفي معظم الحالات لا تسبب المرض لدى النساء أو الرجال. إن وجود الأجسام المضادة الفيروسية في الدم يتحدث فقط عن نقل الميكروب ، لكنه لا يلزم العلاج على الإطلاق. لذلك ، يعتبر متغيرًا من القاعدة.
قد لا تخمن المرأة حتى حول العربة ، يتم تحديد العدوى متى الفحص المقررأو الحمل. تظهر أعراض المرض لأول مرة عند سقوط المناعة. يمكن أن يكون هذا مع نقص المناعة ، ولا سيما فيروس نقص المناعة البشرية ، وعلم أمراض الأورام في المرحلة النهائية ، مع تناول مثبطات المناعة.

ينتمي الفيروس المضخم للخلايا إلى مجموعة فيروسات الهربس وينتقل ، على التوالي ، بنفس الطريقة. العدوى الأكثر احتمالا هي عن طريق الهواء وتنتقل عن طريق الاتصال الجنسي. ومع ذلك ، هناك أيضًا طريقة منزلية للتوزيع ، من خلال عمليات نقل الدم وزرع الأعضاء ، وكذلك الطفل من الأم أثناء الولادة أو أثناء الرضاعة.
إن التعرف على المرض وعلاجه معقد بسبب حقيقة أن عدوى الفيروس المضخم للخلايا لا تتمتع بالخصائص المميزة له. يمكن أن يستمر بشكل مختلف: ببطء (مثل نزلات البرد) أو بشكل حاد مع قفزة حادة في درجة الحرارة وأعراض مشابهة لداء كريات الدم البيضاء.
في الحالة الأولى ، يعاني المريض من درجة حرارة تحت الحمى ، وآلام في المفاصل وانخفاض في الأداء ، وسعال مع سيلان في الأنف ، كما هو الحال مع أي عدوى في الجهاز التنفسي.
وفي حالة وجود مسار شبيه بعدد كريات الدم البيضاء ، فمن المحتمل حدوث زيادة متعددة في الغدد الليمفاوية واللوزتين والأنسجة اللمفاوية (لويحات) الأمعاء. في بعض الأحيان يتضخم الطحال والكبد أيضًا ، وقد يظهر طفح حويصلي (فقاعي) على الجسم (وإن كان في حالات نادرة). عن طريق إصابة الغدد اللعابية ، يمكن للفيروس المضخم للخلايا أن يسبب زيادة إفراز اللعاب.
المضاعفات
أثناء وجوده في الجهاز التناسلي للمرأة ، يمكن تنشيط الفيروس المضخم للخلايا العمليات الالتهابيةالرحم والغدد التناسلية المصحوبة بظهور إفرازات مهبلية مرضية. عندما تنخفض المناعة لدرجة أن الفيروس يتجاوز الغدد اللعابية والمخاطية ، يمكنه التقاط جميع الأعضاء الداخلية.
لذلك ، في المرضى الضعفاء المصابين بالإيدز أو أمراض الأورام ، من الممكن حدوث تعفن أو التهاب السحايا بالفيروس المضخم للخلايا ، مما يؤدي إلى الوفاة بدون علاج فوري.
وبالطبع ترتبط المضاعفات الرئيسية لهذه العدوى بالحمل والتغذية.

